TRATTAMENTO DEI FIBROMI UTERINI CON ULTRASUONI FOCALIZZATI
C. CATALANO*, F. CIOLINA*, A. NAPOLI*
Introduzione
Gli ultrasuoni focalizzati guidati da risonanza magnetica rappresentano una nuova metodica non invasiva per l’ablazione di tumori sia benigni che maligni (1).
Questa tecnica associa l’energia termica sviluppata da un fascio di ultrasuoni ad elevata energia alla guida della risonanza magnetica.
L’energia termica (55-90 °C) sviluppata dalla focalizzazione di ultrasuoni ad elevata energia su un tessuto target e mantenuta per alcuni secondi permette di denaturare le proteine, danneggiare irreversibilmente le cellule e causare una necrosi colliquativa senza danneggiare i tessuti circostanti. La guida della risonanza magnetica permette invece di pianificare e monitorare il trattamento grazie a sequenze morfologiche oltre che sequenze specifiche per la misurazione delle temperature raggiunte dal tessuto oggetto di trattamento e dei tessuti circostanti (1).
I fibromi uterini sono stati tra i primi tumori benigni ad essere trattati con questa metodica a partire dal 2001 (2). Ad oggi sono state trattate nel mondo più di 8000 pazienti con risultati molto promettenti sia in termini di risoluzione dei sintomi che di riduzione delle dimensioni dei fibromi a 3, 6, 12 e 24 mesi ed una minima percentuale di complicanze (3,4).
La riduzione dei sintomi è generalmente misurata utilizzando il symptom severity (SS) score mentre la qualità della vita misurata con l’heath related quality of life score (HRQL) (5).
Nei primi studi è stata riportata una riduzione dei sintomi di circa 10 punti nel 79% delle pazienti; questa percentuale è salita al 91% negli studi in cui sono stati ablati volumi maggiori (6).
In un follow-up a 24 mesi di 359 pazienti sottoposte a trattamento con ultrasuoni focalizzati è stato dimostrato come ad ampi volumi non perfusi a termine del trattamento si associ una significativa e duratura riduzione dei sintomi oltre che riduzione di dimensione dei fibromi; solo nel 15% delle pazienti è stato necessario un re-intervento a 12 mesi (7).
In termini di rapporto costo-beneficio questo trattamento ha mostrato avere un livello di gradimento più alto rispetto ad altre metodiche (es. l’embolizzazione uterina) (8).
È stato inoltre proposto l’utilizzo di questo tipo di trattamento per l’adenomiosi già a partire dal 2006 con effetti positivi sulla riduzione dei sintomi oltre che sulla riduzione di dimensioni dell’area di adenomiosi e la possibilità di gravidanze (9,10, 11, 12).
Criteri d’inclusione ed esclusione.
Attualmente non esiste un consensus a livello internazionale che stabilisca i criteri d’inclusione per un trattamento efficace.
Nei primi studi effettuati il trattamento era riservato unicamente a donne sintomatiche in pre-menopausa che non avevano un desiderio di gravidanza in quanto ancora sperimentale; una volta ricevuta l’approvazione sia dalla FDA che dalla Comunità Europea, è stato possibile allargare i criteri d’inclusione alle donne in età riproduttiva ed in particolare alle pazienti con il desiderio di preservare l’utero in vista di una gravidanza (13). Oltre i sintomi l’indicazione al trattamento viene stabilita sulla base di criteri morfo-strutturali: diversi studi hanno dimostrato come i fibromi poco cellulati (ipointensi nelle sequenze T2 pesate) e poco vascolarizzati rispondano meglio al trattamento ablativo (14).
I criteri di esclusione sono quelli legati in generale alla RM (presenza di pacemaker, valvole cardiache..), la presenza di una gravidanza in atto o di cicatrici a livello della parete addominale anteriore, il BMI superiore a 35 e la concomitanza di altre patologie severe. Sono inoltre da scartare i fibromi molto cellulati (iperintensi nelle sequenze T2 pesate), con calcificazioni, peduncolati, molto vascolarizzati, troppo numerosi (più di 5) e di dimensioni superiori a 10 cm (15).
La tecnica.
L’ExAblate 2010 è uno dei sistemi per l’ablazione dei fibromi uterini maggiormente diffusi negli Stati Uniti ed in Europa. Questo sistema (approvato sia della FDA che della Comunità Europea già nel 2004) viene generalemente accoppiato ad uno scanner RM 1.5 Tesla o a 3 tesla (16).
Il giorno del trattamento la paziente, a digiuno, viene preparata posizionando un accesso venoso per la somministrazione dei farmaci antidolorifici e tranquillanti ed un catetere vescicale per l’eventuale necessità di spostare l’utero e/o le anse intestinali interposte tra fibroma e parete addominale. Si procede inoltre alla depilazione della cute in corrispondenza dell’area da sottoporre a trattamento ed alla copertura di eventuali cicatrici sulla parete addominale con un cerotto dedicato.
Successivamente la paziente viene posizionata prona sul lettino della risonanza, con la pelvi in corrispondenza della sonda integrata nel lettino stesso, le viene dato un pulsante con il quale potrà bloccare il trattamento ogni volta che sentirà dolore eccessivo, viene riempito il retto con gel ecografico per spostare anteriormente l’utero ed avvicinarlo così alla sonda e vengono posizionati i device per il monitoraggio di pressione arteriosa, saturazione di ossigeno nel sangue ed elettrocardiogramma.
Il trattamento consiste di 4 fasi (17):
1. La pianificazione effettuata tramite acquisizione immagini T2 pesate nei tre piani dello spazio e delimitazione della cute, delle anse intestinali, delle strutture ossee e nervose, del volume oggetto di trattamento;
2. La verifica del corretto funzionamento della macchina e dell’assorbimento dell’energia da parte del fibroma con due sonicazioni di cui una prima a bassa energia (200-400 Joule), seguita da una seconda con energia superiore (1000 J).
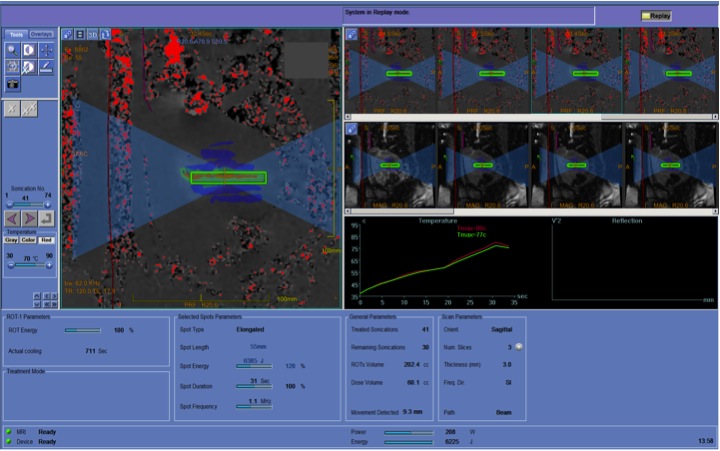
3. Il trattamento vero e proprio in cui il software stabilisce il numero di sonicazioni (piccoli volumi cilindrici) necessario a coprire il volume di trattamento. In questa fase alla paziente vengono somministrati farmaci per alleviare il dolore (fig.1).

Figura 1. Esempio di mappe termiche durante la sonicazione.
4. Il controllo post-trattamento in cui vengono acquisite immagini T1 pesate nei tre piani dello spazio dopo somministrazione di mdc per la valutazione del volume non perfuso ottenuto (fig.2)
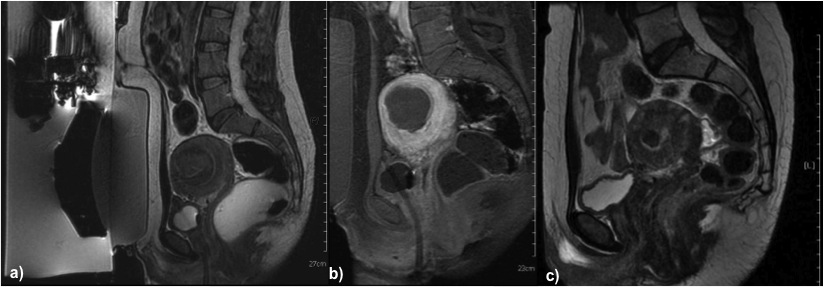
Figura 2. Donna, 40 anni con cicli molto abbondanti. In a) l’immagine T2 sagittale dimostra la presenza di un fibroma sottomucoso a livello della parete anteriore del corpo uterino di 6 cm circa; in b) controllo con mdc a termine del trattamento; in c) il controllo a 3 mesi dimostra una significativa riduzione di dimensioni del mioma.
Esperienza personale
A partire da Agosto 2010 sono state trattate circa 180 pazienti sintomatiche (età compresa tra i 32 ed i 49 anni), per un totale di 255 fibromi, utilizzando il sistema ExAblate 2010 accoppiato ad uno scanner RM 3 tesla (Discovery® HD, GE Healthcare, Milwaukee, WI, USA). In tutte le pazienti sono stati valutati i sintomi e la qualità della vita oltre che il volume dei fibromi da sottoporre al trattamento in fase pre-trattamento. Sono stati considerati come risultati a breve termine il volume non perfuso ottenuto (VNP) subito dopo il trattamento, mentre come risultati a lungo termine la riduzione dei sintomi, il miglioramento della qualità della vita (misurati con il Symtomps Severity Score e High Related Quality of Life Score) e la riduzione di dimensione dei fibromi a 3, 6 e 12 mesi.
Durante il follow-up abbiamo osservato un significativo miglioramento dei sintomi (riduzione di più di 10 punti del Symptoms Severity Score) nel 70% della popolazione trattata, mentre nel 12% è stato necessario re-intervenire con un secondo trattamento con ultrasuoni focalizzati (5%) e con intervento chirurgico di miomectomia/isterectomia (7%). Nei casi rimanenti non c’è stato un significativo miglioramento dei sintomi né un peggioramento.
Abbiamo osservato un’importante correlazione tra il VNP a termine del trattamento e la risposta positiva al trattamento sia in termini di riduzione dei sintomi che del volume del mioma (a 12 mesi del 35-40%) ed è stato così possibile stabilire come elemento predittivo di trattamento ottimale un VNP superiore al 70% (fig.3).
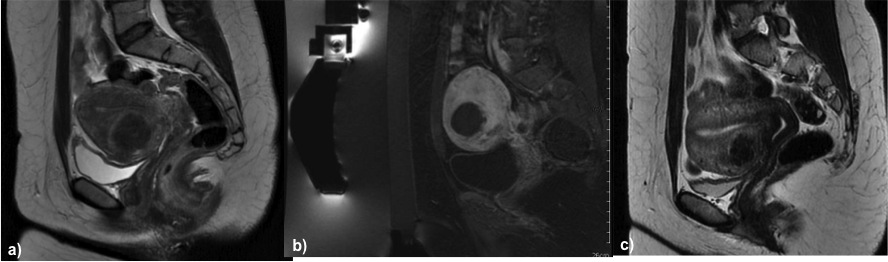
Figura 3. Donna, 32 anni con dolore pelvico, senso di peso sulla vescica e desiderio di gravidanza. a) T2 sagittale pre-trattamento: fibroma intramurale della parete anteriore di 5 cm circa che determina significativa compressione sulla linea endometriale; b) controllo con mdc effettuato a termine del trattamento e c) controllo a 12 mesi dal trattamento . A 18 mesi dal trattamento la paziente ha avuto una gravidanza, al momento in corso.
Nei fibromi sottomucosi abbiamo inoltre osservato come sia possibile l’espulsione del materiale necrotico qualora si crei una soluzione di contiguo tra la superficie del mioma e la cavità uterina (2 casi di cui uno completamente eliminato a 6 mesi con recupero della morfologia normale dell’utero).
Nel corso del follow-up abbiamo osservato 5 gravidanze (3 portate a termine senza problemi, 1 interruzione volontaria di gravidanza ed 1 ancora in corso).
Tra le complicanze abbiamo avuto 3 casi di bruciature cutanee (2 di grado lieve ed 1 moderata) ed in 1 paziente abbiamo avuto lo stupor del nervo sciatico.
Bibliografia
1. Jolesz F. MRI guided focused ultrasound surgery. Annu. Rev. Med. 60, 417–430 (2009).
2. Tempany CM, Stewart EA, McDannold N, et al. 2003. MR imaging-guided focused ultrasound surgery of uterine leiomyomas: a feasibility study. Radiology 226(3):897–905
3. Stewart, E.A., et al., Focused ultrasound treatment of uterine fibroid tumors: safety and feasibility of a noninvasive thermoablative technique. Am J Obstet Gynecol, 2003. 189(1): p. 48-54.
4. Hindley J, Gedroyc WM, Regan L et al. MRI guidance of focused ultrasound therapy of uterine fibroids: early results. AJR Am. J. Roentgenol. 183(6), 1713–1719 (2004).
6. Fennessy FM, Tempany CM, McDannold NJ et al. Uterine leiomyomas: MR imaging-guided focused ultrasound surgery – results of different treatment protocols. Radiology 243(3), 885–893 (2007).
7. Stewart EA, Gostout B, Rabinovici J, et al. CM. Sustained relief of leiomyoma symptoms by using focused ultrasound surgery. Obstet. Gynecol. 110(2 Pt 1), 279–287 (2007).
8. Zowall H, Cairns JA, Brewer C, et al. Cost–effectiveness of magnetic resonance-guided focused ultrasound surgery for treatment of uterine fibroids. BJOG 115(5), 653–662 (2008).
9. Polina L, Nyapathy V, Mishra A, et al. Noninvasive treatment of focal adenomyosis with MR-guided focused ultrasound in two patients. Indian J Radiol Imaging. 2012 Apr;22(2):93-7
10. Rabinovici J, Inbar Y, Eylon SC, et al. Pregnancy and live birth after focused ultrasound surgery for symptomatic focal adenomyosis: a case report. Hum Reprod. 2006 May;21(5):1255-9.
11. Yoon SW, Kim KA, Cha SH, et al. Successful use of magnetic resonance-guided focused ultrasound surgery to relieve symptoms in a patient with symptomatic focal adenomyosis. Fertil Steril. 2008 Nov;90(5):2018.e13-5.
12. Fukunishi H, Funaki K, Sawada K, et al. Early results of magnetic resonance-guided focused ultrasound surgery of adenomyosis: analysis of 20 cases. J Minim Invasive Gynecol. 2008 Sep-Oct;15(5):571-9.
13. Rabinovici J, David M, Fukunish J, et al. Pregnancy outcome after magnetic resonance guided focused ultrasound surgery (MRgFUS) for conservative treatment of uterine fibroids. Fertil. Steril. 93(1), 199–209 (2010).
14. Lenard et al; Uterine Leiomyomas: MR Imaging– guided Focused Ultrasound Surgery—Imaging Predictors of Success Radiology (2008).
15. Sang-Wook Yoon et al; Patient selection guidelines in MR-guidedfocused ultrasound surgery of uterine fibroids: a pictorial guide to relevant findings in screening pelvic MRI. Eur Radiol (2008).
16. EA Dick, WMW Gedroyc. ExAblate magnetic resonance-guided focused ultrasound system in multiple body applications. Expert Rev. Med. Devices 7(5), 589–597 (2010).
17. Tempany CM. From the RSNA refresher courses: image-guided thermal therapy of uterine fibroids. Radiographics 27(6), 1819–1826 (2007).
Carlo CATALANO*, Federica CIOLINA*, Alessandro NAPOLI*
*Dipartimento di Scienze Radiologiche Oncologiche e Anatomo-Patologiche
Sapienza Università di Roma