La Anafilassi da alimenti in età pediatrica
Mauro Calvani
La prima descrizione di morte per anafilassi si attribuisce classicamente ad un geroglifico che descrive la morte del Faraone Menes nel 4500 AC a causa della puntura di una vespa, anche se di recente questa affermazione è stata messa in dubbio, dato che il suddetto Faraone sembrerebbe essere più una figura mitologica che non reale, e sarebbe morto non per colpa dell’anafilassi da puntura di una vespa o di un calabrone, ma forse per colpa di un ippopotamo o perché sbranato da un cane e da un coccodrillo. [1]
A parte questa descrizione mitologica, già nel 1839 Magendie [2] descrisse la morte improvvisa di cani in seguito a ripetute iniezioni di bianco di uovo, e nel 1901 Paul Portier e a Charles Richet osservarono la morte accidentale di alcuni animali, che non sembrava legata alla dose della tossina iniettata [3]. Tutti i cani che erano morti dopo la seconda iniezione della tossina, in specie se la iniezione veniva eseguita oltre 14-23 giorni dalla precedente. Il fenomeno era indipendente dalla dose somministrata, che era ben inferiore alla dose tossica. Essi lo chiamarono anafilassi, per indicare una mancata protezione o anzi una anti-protezione (ovvero il contrario “ana” della protezione “phylaxis”), proprio per distinguere questo evento dalla profilassi, la protezione, che loro avrebbero voluto evocare somministrando la tossina [4].
Nel tempo sono state proposte numerose definizioni della Anafilassi. Tutto ciò ha avuto come importanti conseguenze il verificarsi di diversità nell’approccio diagnostico e quindi terapeutico ma anche ostacolare la acquisizione di dati circa la reale diffusione epidemiologica della anafilassi per la difficoltà di paragonare studi che impiegavano definizioni diverse.
Secondo la più recente definizione, la Anafilassi è “una seria reazione allergica, rapida nell’esordio e che può essere mortale”. e soprattutto i seguenti nuovi criteri diagnostici: La anafilassi è molto probabile se viene soddisfatto uno dei seguenti 3 criteri
1) Esordio acuto (da minuti a alcune ore) con coinvolgimento della cute o delle mucose o di entrambe (es. orticaria generalizzata, prurito o flushing, rigonfiamento di labbra, lingua, ugola)
E almeno uno dei seguenti
a) Compromissione respiratoria (dispnea, broncosoasmo, stridore, riduzione del PEF, ipossiemia)
b) Riduzione della pressione arteriosa o sintomi di disfunzione di organo [ipotonia (collasso), sincope, incontinenza]
2) Due o più dei seguenti che si verifichino rapidamente dopo la esposizione a un probabile allergene per quel paziente (da minuti a alcune ore)
a) Interessamento della cute-mucose (come sopra)
b) Compromissione respiratoria (come sopra)
c) Riduzione della pressione arteriosa o sintomi associati (come sopra)
d) Sintomi gastrointestinali persistenti (dolori addominali crampiformi, vomito)
3) Riduzione della pressione arteriosa dopo esposizione a un allergene conosciuto per quel paziente (da minuti a alcune ore)
a) nei lattanti e bambini: bassa pressione sistolica (per l’età) o diminuzione di oltre il 30% della pressione sistolica
b) adulti: pressione sistolica inferiore a 90 mmHg o riduzione di oltre il 30% della pressione basale
Chiaramente questi criteri identificano solo i casi “classici” di anafilassi e non identificano invece quei casi in cui la anafilassi si manifesta ad esempio con una improvvisa ipotensione o shock senza evidente esposizione ad allergene noto o la anafilassi da esercizio. [5]
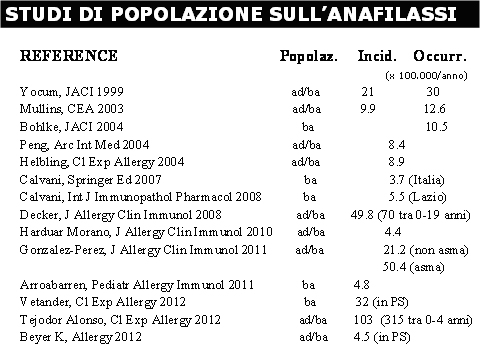
Ancora oggi è difficile definire quale sia l’esatta frequenza dell’anafilassi nella popolazione. . Gli studi di incidenza dell’anafilassi hanno prodotto risultati assai differenti, in rapporto all’età della popolazione studiata, al setting operativo, al disegno dello studio e alla definizione stessa adoperata per caratterizzare l’evento. Per quanto concerne l’incidenza, nel complesso gli studi population-based sono assai pochi e la maggioranza di essi include pazienti sia pediatrici che adulti e ha un disegno retrospettivo. Grossolanamente si può ritenere che l’incidenza reale dell’anafilassi oscilli tra 3.2/100.000 e 90/100.000 individuo-anno. Limitandosi comunque a considerare solo gli studi più recenti population-based e nei quali siano stati inclusi tutti i casi di anafilassi, a prescindere dalla presenza o meno di interessamento cardio-circolatorio (rilevabile in non più del 10-25% del totale dei casi), i pochi lavori disponibili hanno riportato un’incidenza variabile da 3.7 e 103 su 100000 individui-anno. (Tabella 1)
La mortalità per anafilassi aumenta con l’aumentare dell’età ed è quindi minore in età pediatrica rispetto alle età successive [6]. Uno studio di popolazione eseguito in Florida ha dimostrato che varia da 0.0096 casi x 100.000 abitanti nella fascita di età 5-14 anni a 0.13 casi nella fascia oltre 65 anni [7]. In Italia uno studio recente eseguito nel Lazio nel periodo 2000-2003 ha mostrato una mortalità pari a 0.038 casi/100.000 bambini di età < 17 anni, pari a 1 caso ogni 209 episodi [8].
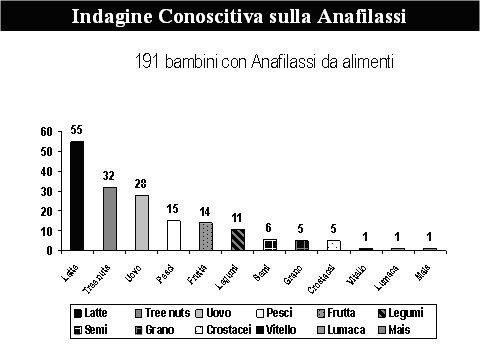
Gli alimenti costituiscono la causa più frequente di anafilassi in età pediatrica, mentre nell’adulto prevale la eziologia da farmaci e da puntura di insetto. Nel mondo occidentale gli alimenti più frequentemente implicati sono le arachidi, le noci varie (nocciole, noci, mandorle, pistacchi, pinoli,noci brasiliane), seguite da animali marini (pesci, molluschi e crostacei), quindi latte vaccino e uovo. In Italia il latte vaccino, le noci da guscio, l’uovo e i pesci costituiscono gli alimenti più frequentemente riscontrati in un recente studio multicentrico eseguito dalla Commissione per le Allergie Alimentari, Anafilassi e Dermatite Atopica della Società Italiana di Immunologia e Allergologia Pediatrica. [9] (Figura 1)
La attivazione delle mast cellule e dei basofili con la conseguente rapida liberazione di citochine, chemochine e altri mediatori è alla base della alterazioni fisiopatologiche che portano al quadro clinico della anafilassi. Questo può avvenire ad opera di meccanismi immunologici IgE dipendenti, ma anche non IgE dipendenti [10]. La anafilassi da alimenti si verifica solo attraverso meccanismi IgE dipendenti mentre quella da farmaci può verificarsi anche mediante meccanismi non IgE dipendenti, quali meccanismi citotossici (ad es. le trasfusioni di sangue), da immunocomplessi (ad es. le reazioni alla somministrazione di immunoglobuline), da attivazione del complemento (ad es. le reazioni ai mezzi di contrasto), da una liberazione aspecifica dei mediatori da parte delle mast cellule e dei basofili (ad es le reazioni agli oppioidi). In rari casi è stato ipotizzato l’intervento di meccanismi psicogeni (come la anafilassi somatoforme indifferenziata) e persino non immunologici (traumi meccanici, alta temperatura) [11]. In seguito alla attivazione, le mast cellule e i basofili rilasciano tutta una serie di mediatori, classicamente distinti in preformati e neoformati. I primi sono costituiti da sostanze presenti nei granuli secretori, come la istamina, la triptasi, le chimasi e la eparina, e dalla istamin-releasing factor, oltre che da altre citochine. I mediatori neoformati vengono sintetizzati a partire dai lipidi delle membrane cellulari, e sono costituiti principalmente da alcune prostaglandine (PGD2) e alcuni leucotrieni (LTB4), ma anche dal Fattore attivante le piastrine (PAF) e dai cisteinil leucotrieni (LTC4, LTD4, LTE4). Ogni mediatore determina uno o più effetti fisiologici, che portano al quadro clinico della Anafilassi. La liberazione di istamina determina aumento della permeabilità vascolare con comparsa di prurito, rinorrea, broncospasmo, (recettori H1) oltre che di cefalea e flushing (recettori H1 e H2). A livello cardiaco inoltre l’istamina determina vasocostrizione delle arterie coronariche e aumento della permeabilità mediante lo stimolo dei recettori H1, mentre lo stimolo dei recettori H2 induce aumento della forza di contrazione sia atriale che ventricolare oltre che vasodilatazione coronarica[12].
La triptasi è la sola proteina che si concentra selettivamente nei granuli secretori delle mast cellule umane e livelli di triptasi, in alcuni lavori, sembrano correlarsi alla severità della anafilassi. La alfa triptasi è una proteina simile, prodotta dalle mast cellule in fase riposo, ed aumentata nelle mastocitosi. La beta triptasi, anch’essa contenuta nei granuli secretori, è stabile nel siero per alcuni giorni: il suo dosaggio è quindi più specifica per la anafilassi [13] : seppure non sempre presente nelle anafilassi, è di solito elevata nelle reazioni anafilattiche con shock. [14]
Il coinvolgimento di diversi sistemi di organo determina il decorso clinico dei vari casi di anafilassi, qualunque ne sia la causa. Il principale organo di shock varia in base alla specie (nel cane è il sistema venoso epatico, nel topo l’apparato cardiovascolare, nell’uomo sono principalmente l’apparato respiratorio e quello cardiovascolare). Altri fattori che contribuiscono a determinare l’interessamento di uno specifico organo sono legati anche a variazioni nella risposta immune, alla localizzazione delle fibrocellule muscolari, e alla distribuzione, metabolismo e reattività ai vari mediatori rilasciati.
Un ruolo centrale nella patogenesi del quadro clinico della anafilassi è certamente giocata dalla ipotensione. Questa può associarsi a vasodilatazione (eritema cutaneo) o a rapido esordio dello shock, con conseguente vasocostrizione cutanea (cute pallida e fredda).
L’aumento della permeabilità vascolare durante l’anafilassi è di fondamentale importanza al fine della gravità del quadro clinico, dato che se si verifica può essere cosi’ massiva da permettere il passaggio del 35-50% dei liquidi intravascolari nello spazio extravascolare in soli 10 minuti [15].
Le principali alterazioni cardiovascolari che si riscontrano nella anafilassi sono quindi indotte dalla vasodilatazione e dallo stravaso di liquidi, che determinano un insieme di shock distributivo e ipovolemico. Il volume ematico circolante può diminuire rapidamente nel giro di 10 minuti per effetto dello stravaso e la vasodilatazione può essere cosi’ importante da resistere alla somministrazione di adrenalina, e rispondere solo, talora, a potenti vasocostrittori, come la vasopressina. Per quanto riguarda l’interessamento dell’apparato respiratorio, il rapido sviluppo di edema, ipersecrezione e di flogosi allergica a livello delle alte vie, è alla base dei sintomi respiratori (starnuti, rinorrea, prurito nasale). L’interessamento del laringe, testimoniato dall’edema e dall’infiltrato di eosinofili agli esami autoptici, si manifesta con tosse secca a timbro metallico e dalla sensazione di ingombro con difficoltà respiratoria. Questo si verifica più frequentemente nel caso di anafilassi da alimenti piuttosto che nei casi dovuti a puntura di insetto o da farmaci, probabilmente anche per la reazione indotta dal contatto locale, e può essere causa di una importante difficoltà respiratoria con ipossiemia ed acidosi [16].
L’interessamento delle basse vie respiratorie è dovuto all’edema, alla ipersecrezione ma anche alla broncoconstrizione, caratteristiche dell’asma, e si verifica appunto più frequentemente nei bambini, nella anafilassi da alimenti e nei soggetti già sofferenti di asma.
I sintomi di anafilassi sono altamente variabili, coinvolgono usualmente più apparati in rapida progressione, e spaziano da lievi manifestazioni cutanee a sintomi cardiovascolari con esito potenzialmente mortale.
I sintomi cutanei come orticaria, angioedema, arrossamento e prurito sono le più frequenti manifestazioni cliniche di una reazione anafilattica, verificandosi nel 90% dei pazienti in tutti gli studi sull’anafilassi che includono anche le serie pediatriche. L’orticaria associata con l’anafilassi è caratterizzata da un’eruzione a rapida evoluzione, che si verifica nel corso di pochi secondi fino a qualche minuto e che si differenzia da una reazione allergica cutanea stabile e non progressiva. É da sottolineare che, l’assenza di sintomi cutanei, non esclude la diagnosi di anafilassi. Dopo i sintomi cutanei i sintomi respiratori, sono quelli più frequentemente rappresentati nei casi di anafilassi pediatrica e sono per lo più costituiti da angioedema delle vie respiratorie superiori, con raucedine tosse abbaiante e sensazione di ingombro respiratorio alto e broncospasmo. Analogamente frequenti sono i sintomi gastrointestinali rappresentati da vomito, crampi e dolori addominali, diarrea. E’ stato inoltre riportato che, nell’ adulto, i sintomi gastrointestinali sarebbero maggiormente predittivi di gravità della reazione e tale osservazione è stata da noi recentemente confermata nei bambini: la presenza di sintomi gastrointestinali si associa fortemente alla insorgenza di ipotensione 9. Le manifestazioni cardiovascolari, causa più frequente di mortalità nell’adulto, sono meno frequenti in età pediatrica, forse anche perché più difficili da valutare in un lattante o in un bambino molto piccolo. Un’estrema irritabilità ed un pianto disperato possono costituire gli iniziali sintomi neurologici di una reazione anafilattica ed anticipare la fase di torpore e di perdita di coscienza.
La diagnosi di anafilassi è volta sia a caratterizzare l’evento come tale sia a precisarne l’eziologia, ma naturalmente anche ad escludere altre patologie che possono entrare nella diagnosi differenziale con quest’affezione. E’ ovvio che, in presenza di una storia clinica suggestiva e di una sensibilizzazione rilevante verso l’allergene indiziato, la diagnosi eziologica e quella generica di anafilassi coincidono. In altre parole, la dimostrazione di una sensibilizzazione al prick test o alla determinazione delle IgE specifiche nei confronti di uno specifico allergene in un bambino con una storia di reazione da ipersensibilità severa dopo esposizione allo stesso consentono in un sol tempo di formulare una diagnosi di anafilassi e di identificare l’allergene causale. In generale i test cutanei sono accreditati di una maggiore sensibilità diagnostica rispetto alla determinazione delle IgE specifiche e rappresentano la procedura di elezione nella identificazione della maggior parte degli allergeni causali, specie quando siano implicati alimenti [17]. Ove disponibili, gli skin prick test andrebbero sempre eseguiti con estratti diagnostici standardizzati (anche se in alcuni casi, soprattutto nel caso di allergeni vegetali, l’impiego dell’alimento naturale con la metodica del prick+prick può assicurare una maggiore sensibilità diagnostica)[18] . Nei casi con storia clinica suggestiva ma con test cutaneo negativo andrà sempre eseguita la ricerca in vitro delle IgE specifiche. la determinazione dei livelli sierici di triptasi e di istamina ha un basso valore diagnostico. Infatti la triptasi non è sempre elevata nella anafilassi da alimenti e comunque si eleva 60-90 minuti dopo l’esordio dell’anafilassi e persiste elevata per circa 5 ore[19] . Il periodo migliore per dosare la triptasi ematica è da 1 a 2 ore dopo l’evento, non superando le 6 ore dall’inizio dei sintomi. L’istamina aumenta nel sangue già dopo 5-10 minuti dall’evento e ritorna a valori di normalità dopo appena 30-60 minuti. Più a lungo invece (fino a 24 ore) permangono livelli elevati del suo metabolita (metil-istamina) nelle urine a seguito di un episodio di anafilassi.
Particolarmente complessa è la diagnosi di anafilassi da sforzo alimento-dipendente. Questa si manifesta solo in seguito allo sforzo e ne esiste una forma alimento dipendente (specifica e non specifica) e una forma non alimento dipendente (dovuta solo allo sforzo). Nella forma alimento dipendente specifica il bambino è sensibilizzato all’alimento (presenta Skin Prick Test positivi) ma tollera sempre l’alimento, tranne quando dopo averlo mangiato compie attività fisica. In quel caso insorge la anafilassi. Nella forma non specifica alimento dipendente (descritta soprattutto nell’adulto) l’anafilassi insorge quando dopo un qualsiasi pasto viene compiuta attività fisica. Nei casi in cui la storia clinica non è chiara, è talora necessario ricorrere al test di provocazione orale combinato con un test da sforzo a distanza di 30-90 minuti dal pasto [20]. In questi bambini è obbligatorio il monitoraggio, oltre che dei parametri vitali anche della funzionalità respiratoria fino a 2-3 ore dal completamento del test. In rari casi di anafilassi da sforzo alimento-specifica possono essere implicati più alimenti insieme, i quali, se assunti separatamente prima del test da sforzo, possono risultare in un test falsamente negativo [21]. La somministrazione insieme all’alimento sospetto anche dell’ acido acetil salicilico, che aumentando la permeabilità intestinale, è in grado di facilitare la comparsa del quadro clinico.
L’approccio terapeutico al paziente con reazione anafilattica comprende il supporto delle funzioni vitali e l’impiego di misure specifiche volte a contrastare i processi patologici innescati dai mediatori dell’anafilassi.
Schematicamente le fasi di intervento da eseguirsi rapidamente sono:
· Garantire l’ABC primario, secondo uno schema di priorità ben preciso, identificato dagli autori anglosassoni:
A = airway: pervietà delle vie aeree
B = breathing: ventilazione o respirazione
C = circulation: circolazione sanguigna
Inoltre è necessario valutare le condizioni neurologiche, dato che una alterazione dello stato mentale suggerisce la presenza di ipossia
· Somministrare adrenalina: la dose è 0.01 ml/kg di una soluzione acquosa di adrenalina 1:1000 (dose max 0.5 mg) per via intramuscolare profonda, preferibilmente nel muscolo vasto laterale della coscia. [22]
· Stendere il paziente sul dorso sollevandogli le gambe in posizione antishock, allo scopo di ridistribuire la massa circolante e favorire la perfusione degli organi vitali. Se non vi è dispnea porre il paziente in Trendelenburg. Tenere sollevato o in posizione eretta il paziente potrebbe diminuire il ritorno venoso e causare un arresto cardiaco.
· Chiamare il 118, coinvolgere tutto il personale esperto e allontanare le persone estranee
· Raccogliere rapidamente la anamnesi, cercando di individuare la causa più probabile e laddove possibile cercando di rimuoverla (ad es. togliendo il pungiglione se si tratta di una puntura di insetto o applicando un laccio intorno alla sede di somministrazione di un farmaco
· Monitorare continuamente i segni vitali (attività cardiaca e respiratoria e pressione arteriosa) e assicurarsi di mantenere la pervietà delle vie aeree, poiché la sintomatologia può peggiorare rapidamente verso un’ostruzione completa delle vie aeree e/o uno stato di shock fino all’arresto cardio-respiratorio
· Somministrare farmaci di supporto, quali antistaminici, broncodilatatori, steroidi, liquidi EV, O2 in maschera, etc.
· In caso di mancato miglioramento o progressione della sintomatologia, è possibile ripetere la somministrazione della adrenalina dopo 5-15 minuti.
· Tutti i casi di anafilassi devono essere inviati in ospedale, per la possibilità di forme bifasiche, ovvero del ripresentarsi della sintomatologia dopo 6-8 ore, pur senza essere di nuovo venuti a contatto con l’allergene. Per tale motivo è consigliata l’osservazione del paziente in regime di ricovero per un periodo di 6 - 24 ore, a seconda delle situazioni cliniche.
· In accordo a quanto raccomandato dalla American Academy of Allergy Asthma and Immunology, si suggerisce di inviare ad una consulenza allergologica ogni bambino affetto da un episodio di anafilassi per un approfondito inquadramento diagnostico e terapeutico. Questo perché la anafilassi è un evento potenzialmente grave e mortale, che tende a ripetersi.
La principale strategia nella gestione del bambino a rischio di anafilassi é innanzi tutto la prevenzione degli episodi futuri. Una volta individuato il fattore causale dell’anafilassi, occorre instaurare una strategia per evitarlo ed insegnare, a tutte le persone che abitualmente stanno vicine al bambino, il comportamento da adottare in caso di eventuale nuova esposizione. Un altro momento importante per prevenire le importanti manifestazioni cliniche dell’anafilassi è la corretta prescrizione della giusta dose dell’adrenalina autoiniettabile. E’ necessario inoltre spiegare ai genitori i sintomi della anafilassi e come somministrare la adrenalina. A questo fine molto utile risulta la consegna di un Piano di Azione scritto, che illustri cosa fare e quando somministrare il farmaco.
In commercio esistono attualmente solo 2 tipi di adrenalina auto iniettabile (FastJect e Jext), entrambe con solo 2 posologie (circa 0.165 mcg e 0,300 mcg).
Tabella 1

(Figura 1)
Bibliografia
[1] Krombach JW, Kampe S, Keller CA, Wright FM: Pharaon Menes’ death after an anaphylactic reaction – the end of a myth. Allergy 2004; 59: 1234-35
[2] Magendie F. Lectures on the blood. Philadelphia: Harrington, Barrington, and Haswell; 1839. p. 244.
[3] Cohen SG, Zelaya-Quesada M: Portier, Richet and the discovery of anaphylaxis: a centennial. J Allergy Clin Immunol 2002; 110: 331-6
[4] Richard J. Les campagnes scientifique de S.A.S. le Prince de Monaco. Bull Inst Oceanogr 1910;7:162. Cited by: May CD. The ancestry of allergy: being an account of the original experimental induction of hypersensitivity recognizing the contribution of Paul Portier. J Allergy Clin Immunol 1985 ; 75:485-95.
[5] Sampson HA, Munoz-Furlong A, Campbell RL, Adkinson NF, Bock SA, Branum A, Brown SGA et al. Second symposium on the definition and management of anaphylaxis; summary report. Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol 2006; 117: 391-7
[6] Liew WK, Williams E, Tang MLK: Anaphylaxis fatalities and admissions in Australia. J Allergy Clin Immunol 2009; 123: 434-42
[7] Simon MR , Mulla ZD: A Population-based epidemiologic analysis of deaths from anaphylaxis in Florida. Allergy 2008; 63: 1077-83
[8] Calvani M, Di Lallo D, Spinelli A, Polo A, Zicari AM, Zappala D: Hospitalizations for pediatric anaphylaxis. Int J Immunopathol Allergol 2008; 21: 975-81
[9] Calvani M, Crdinale F, Martelli A, Muraro A, Pucci N et al. Risk factors for severe anaphylaxis in Italy. Pediatr Allergy Immunol 2011; 22: 813-9
[10] Payne V, Kam PCA: Mat cell tryptase: a review of its physiology and clinical significance. Anaesthesia 2004; 59: 695-703
[11] Kemp SF, Lockey RF: Anaphylaxis: a review of causes and mechanism. J Allergy Clin Immunol 2002; 110: 341-8
[12] Mitsuhata H, Shimizu R, Yokoyama MM. Role of nitric oxide in anaphylactic shock. J Clin Immunol 1995;15:277-83.
[13] Schwartz LB, Yunginger JW, Miller J, et al. Time course of appearance and disappearance of human mast cell tryptase in the circulation after anaphylaxis. J Clin Invest 1989;83: 1551–5.
[14] Pumphrey RSH, Roberts ISD: Postmortem findings after fatal anaphylactic reactions. J Clin Pathol 2000; 53: 273-6
[15] Fisher MM. Clinical observations on the pathophysiology and treatment of anaphylactic cardiovascular collapse. Anaesth Intensive Care 1986;14:17-21
[16] Pumphrey RSH: Anaphylaxis: can we tell who is at risk of a fatal reaction? Curr Opinion in Allergy and Clinical Immunology 2004; 4: 285-90
[17] Lieberman P, Nicklas RA, Oppenheimer J, Kemp SF, Lang DM: The diagnosis and management of anaphylaxis practice parameter: 2010 update. J Allergy Clin Immunol 2010; 126: 477-80
[18] Rosen JP, Selcow JE, Mendelson LM et al Skin testing with natural foods in patients suspected of having food allergies: is it a necessity? J Allergy Clin Immunol 1994; 93:1068-1070
[19] Hamilton RG, Adkinson FA. Clinical and laboratory assessment of IgE-dependent hypersensitivity. J Allergy Clin Immunol 2003; 111:S687-701
[20] Romano A, Fonso M, Giuffreda F et al: Diagnostic work-up for food-dependent, exercise-induced anaphylaxis. Allergy 1995; 50:817-824
[21] Aihara Y, Kotoyori T, Takahashi Y et al. The necessity for dual food intake to provoke food-dependent exercise-induced anaphylaxis (FEIAn): a case report of FEIAn with simultaneous intake of wheat and umeboshi. J Allergy Clin Immunol 2001; 107:1100-1105
[22] Simons FER, Gu X, Simons KJ. Epinephrine absorption in adults: intramuscular versus subcutaneous injection. J Allergy Clin Immunol 2001 ; 108: 871-3
Mauro Calvani
Azienda Ospedaliera S. Camillo – Forlanini
UOC di Pediatria e Ematologia Pediatrica
Ambulatorio Pediatrico Allergologico
Roma