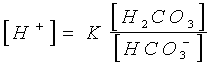
“Gli equilibri omeostatici in Medicina: dalla fisiopatologia alla filosofia”
Francesco Sgambato
con la collaborazione di
Sergio Prozzo,
Ester Sgambato, Luca Milano,
Giovanni Leone Piscitelli, Armando Fucci
Ospedale “Sacro Cuore di Gesù”
Fatebenefratelli - Benevento
Dipartimento di Medicina
Unità Operativa Complessa di Medicina Interna
Primario Dott. Francesco Sgambato
INTRODUZIONE
“L’uomo è unico, irripetibile, in divenire, indivisibile, in relazione, in cerca di equilibrio (chimico-fisico, psichico e spirituale)”.
Queste lapalissiane verità, ogni tanto, devono essere ribadite e, se non bastano le parole, bisogna ridimostrarle con i fatti.
Ippocrate non conosceva gli acidi e le basi, né gli anioni ed i cationi,
ma aveva chiaro il concetto che la buona salute e, quindi,
la sopravvivenza
dipendono da “un giusto equilibrio, che Egli immaginava fosse integrato
tra quattro umori: sangue, flemma, bile nera e bile gialla”.
Claude Bernard (1813-1878) esplicitò per primo, nel 1865, il concetto basilare che l’uomo è immerso in un “milieu interieur”, che funge da sistema unificante di tutto l‘organismo, ed il cui equilibrio deve essere sempre salvaguardato. (1)
Il mantenimento della omeostasi di questo “milieu interieur” rappresenta in definitiva uno degli elementi più importanti ai fini della conservazione della vita e la sua conoscenza è indispensabile nella clinica medica pratica.
Ogni nostra funzione vitale, infatti, è legata alla stabilità di questo “mezzo interno” ed è essenzialmente basata su una “volgare fondamentale trinità”: l’equilibrio acido-base, l’equilibrio idro-elettrolitico (ionico) e l’equilibrio osmolare: tre sistemi così interconnessi fra di loro che, qualsiasi modificazione all’interno di uno di essi, si riflette immediatamente anche sugli altri due oltre ad andare ad interferire con il sistema del controllo della volemia (quarto elemento cruciale, ma primo per importanza: “la correzione della volemia viene prima di tutto il resto”).
Riprendendo questi concetti, ci fu un grande fiorire di studi che dettero impulso e contenuti concreti alla grande stagione scientifica della fisiologia generale di fine Ottocento e inizio Novecento, grazie al favoloso “poker d’assi” formato appunto da Claude Bernard (1813-1878) e dai suoi “colleghi di staffetta” Lawrence J. Henderson (1878-1942), Jacques Loeb (1859-1924) e Walter B. Cannon (1871-1945).
Henderson elaborò la sua omonima Equazione di Henderson (1908) cruciale per lo studio dell’Equilibrio acido-base [[2], [3],[4]] e J. Loeb contribuì con la sua omonima formula di Loeb (1916) utile per capire i rapporti intercorrenti fra l’Equilibrio acido-base e l’Equilibrio idro-elettrolitico nel suo libro dal titolo emblematico: “The organism as a whole...” “L’organismo come un intero”, chiara espressione di una mentalità olistica. [[5],[6],[7]
W. B. Cannon, nel 1926, coniò il termine di “omeostasi” per indicare la peculiare caratteristica propria di ogni organismo vivente di mantenere un equilibrio interno, entro un ambito prefissato, grazie a un insieme di processi di regolazione e contro-regolazione che agiscono ogniqualvolta si verifichi una variazione delle condizioni pre-esistenti. Nel 1932 pubblicò il suo famoso libro “The Wisdom of the body” “La Saggezza del corpo” dedicato a questo tema. [8],[9]
Il mantenimento della condizione vitale, infatti, dipende da questo equilibrio “dinamico” di forze contrastanti, ma nelle giuste proporzioni, mantenute stabili da un incredibile sistema di regolatori automatici cooperanti, che agiscono, simultaneamente o in successione, secondo meccanismi di aggiustamento interdipendenti, previsti dai normali processi fisiologici.(10)
Alcuni di questi meccanismi omeostatici dell’organismo umano (es. pH del sangue, equilibrio ionico, equilibrio osmolare, volume plasmatico, temperatura corporea, pressione arteriosa, consumo energetico, etc..) sono strettamente connessi alla sua sopravvivenza”.
Ma, in effetti, nella pratica clinica, di che cosa è fatto questo “milieu interieur”, o, meglio ancora, quali sono gli equilibri omeostatici cruciali da salvaguardare ?
La risposta può essere semplice: sicuramente in primis gli equilibri dell’Ossigeno e degli Idrogenioni e, di conseguenza, quello dell’Acqua; quando, poi, parliamo di acqua viene automaticamente in mente il Sodio, che rappresenta lo “scheletro osmotico dell’organismo” e che è strettamente correlato all’Acqua; di converso, poi, Sodio ed Acqua riportano inevitabilmente al concetto di Volume plasmatico circolante (Volume efficace di sangue arterioso - VESA).
Nelle condizioni cliniche in cui questi sistemi omeostatici vengano alterati bisogna mettere in atto procedure terapeutiche volte a ripristinare le condizioni di equilibrio preesistenti.
In queste condizioni, per mantenere costante (o per ripristinare) il “milieu interieur” di Claude Bernard, è indispensabile che, in qualsiasi istante, vengano salvaguardati quattro “principi fondamentali”:
il principio di “neutralità” (equilibrio acido-base)
il principio di “elettroneutralità” (equilibrio ionico)
il principio di “iso-osmolalità” (equilibrio osmolare)
il principio di “iso-volemia” (equilibrio volemico)
oltre ovviamente all’equilibrio termico ed a quello energetico.
L’EQUILIBRIO ACIDO-BASE
L’organismo umano, per effetto del suo metabolismo, produce in continuazione acidi che, secondo la definizione di Brønsted, sono sostanze capaci di generare idrogenioni (mentre le basi sono capaci di assorbire idrogenioni).
I vari metabolismi (protidico, glicidico e lipidico) attraverso le diverse tappe metaboliche producono, come traguardo finale, tre sostanze : ammoniaca (NH3 ), acqua (H2O) e anidride carbonica (CO2) oltre alla generazione di energia (ATP).
Ogni giorno, quindi, vengono ricavati dai nostri processi metabolici 15.000-20.000 milliEquivalenti (mEq) di CO2, che vengono poi escreti dai polmoni.
Inoltre una normale dieta provoca la formazione di 50-100 mEq di H+ nelle 24 ore. Basti pensare, semplicemente, che l’acqua potabile, proveniente dal rubinetto, non ha pH 7.40, bensì pH variabile intorno a 5 (l’acqua pura ha pH 7); il latte ha pH 6,6; la coca-cola ha pH 2,8; la soluzione fisiologica ha pH al di sotto di 7,0; la soluzione glucosata ha pH oscillante ma sempre acido intorno a 4,5 o 5.0.
La maggiore preoccupazione del corpo umano, quindi, è quella di “difendersi dalla acidità”, perché egli normalmente produce idrogenioni (H+, acidi) e non ossidrilioni (OH-, basi) e, quindi, l’acidosi è molto più frequente dell’alcalosi.
La produzione di idrogenioni avviene in condizioni normali (fisiologiche), mentre l’alcalinità si crea solo per una situazione di patologia; né bisogna dimenticare, al riguardo, che l’idrogeno è l’atomo presente in maggiore abbondanza nelle cellule e che la maggiore quota dell’idrogeno è sotto forma di acqua.
Gli acidi prodotti normalmente, però, prima di raggiungere gli organi emuntori, passano nel sangue e questo passaggio, dalla produzione alla eliminazione, deve avvenire senza modificare la normale concentrazione idrogenionica.
E questa è la più sorprendente qualità dei nostri sistemi omeostatici, come espresso da Henderson Laurence J. (1878-1942) già nel 1908: “The most significant and the most conspicious property of blood is the extraordinary ability to neutralize large amounts of acids or bases without losing its neutral reaction”. (3)
(“La più importante e la più evidente proprietà del sangue è la sua straordinaria abilità nel neutralizzare larghe quantità di acidi o basi senza perdere la sua reazione neutra”).
Sorensen S. P. L. (1868-1939), poi, dimostrò, nel 1909, che “la normale concentrazione dello ione idrogeno è un fattore essenziale in tutti i processi biologici” (11).
Tale concentrazione degli idrogenioni deve oscillare, nella norma, intorno a 40 nanoEq / Litro (corrispondenti ad un pH di 7,40) e variazioni di questi numeri possono alterare tutti i processi metabolici. Se ne può dedurre che gli H+ liberi, in effetti sono presenti in concentrazioni estremamente basse e, se esprimiamo il loro valore normale in milliEq/Litro, essi corrispondono ad un numero di 0,00004 milliEq / L .
Le difese, poste in essere dall’organismo, contro le variazioni di questa
concentrazione idrogenionica normale, si basano su tre differenti sistemi (i tamponi, i polmoni ed i reni) con diversi tempi di intervento.
I sistemi tampone corporei entrano in azione nel giro di pochi secondi ed il sistema tampone bicarbonato/acido carbonico è il più importante di tutti, per tre motivi fondamentali:
- uno, perché è presente in quantità maggiori rispetto agli altri (65 % sul totale);
- due, perché è il più ubiquitario (è presente nel fluido interstiziale, nel plasma, negli eritrociti, nelle cellule, nelle ossa);
- tre, perché è l’unico sistema che ha due vie di sfogo: una, rapida, attraverso i polmoni trasformandosi in CO2 (che viene eliminata immediatamente in pochi minuti) e l’altra ritrasformandosi in bicarbonato ed idrogenioni, i quali ultimi vengono eliminati con il rene.
Il fondamentale segreto del suo successo è che l’acido carbonico è l’unico (tra tutti i sistemi tampone) ad avere una scappatoia all’esterno trasformandosi in qualche cosa di volatile (la CO2) + acqua residua, che non ha più valore dal punto di vista dell’equilibrio acido-base.
Il rene collabora bene, però è più lento ad entrare in azione, ed impiega almeno 8-12 ore solo per dare inizio alla sua azione, che consiste, essenzialmente, nell’eliminare gli acidi fissi e gli idrogenioni sotto forma di acqua nelle urine o di ammonio o di fosfati, oltre alla indispensabile funzione di recuperare i bicarbonati mediante il loro riassorbimento già nel tubulo prossimale.
Circa il 90 % dei bicarbonati viene riassorbito nel primo passaggio glomerulo-tubulare.
I sistemi tampone corporei, infatti, sono presenti in un totale di 2.400 mEq (globalmente), mentre gli acidi da tamponare prodotti nelle 24 ore (volatili e non volatili) sono 15.000-20.000 mEq.
Questa discrepanza, tra gli acidi prodotti nelle 24 ore (15-20.000 mEq) ed il totale dei sistemi tampone corporei, fa intuire la necessità che i tamponi siano continuamente rinnovati nel corso della giornata, a pena di esaurimento delle scorte disponibili.
A questa funzione è deputato il rene con la sua attività di rigenerazione e riassorbimento dei bicarbonato, oltre a quella di eliminare gli acidi fissi.
Ai tamponi organici (basi) è affidato, invece, il ruolo di emergenza ed istantaneità dell’intervento mentre al polmone spetta il compito di eliminare gli acidi volatili (CO2).
Se ci fossero solo i bicarbonati potremmo sopravvivere solo per alcune ore (mezza giornata circa); se ci fossero solo i polmoni potremmo resistere solo per qualche giorno mediante la iperventilazione, fino a quando la fatica muscolare ce lo consentisse; se ci fossero solo i reni moriremmo subito, perchè mentre essi arrivano a funzionare a pieno regime saremmo già morti per eccesso di acidi non più tamponati.
La poco famosa (ma basilare) equazione di Henderson
Laurence J. Henderson (1878-1942) , Professore di Fisiologia ad Harvard (Stati Uniti), abituato a studiare i sistemi biologici dal punto di vista matematico e fisico-chimico, descrisse i sistemi tampone del sangue, li caratterizzò matematicamente ed elaborò (1908) la sua geniale e fondamentale formula, conosciuta come “Equazione di Henderson”: (formula 1) (3).
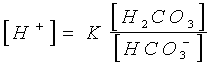
Da questa equazione, generalmente poco nota, fu elaborata la famigerata e superflua Equazione di Henderson- Hasselbalch, molto nota, in cui comparvero gli antipatici logaritmi.
Nella precedente Equazione di
Henderson, invece, già era stata sintetizzata benissimo tutta la problematica
dell’equilibrio acido-base, ovverosia che la concentrazione degli idrogenioni (e
quindi l’acidità o la basicità di una soluzione) è data dal rapporto
quantitativo esistente fra la concentrazione dell’acido carbonico (H2CO3,
al numeratore) e la concentrazione dei bicarbonati
(HCO3-, al
denominatore) secondo una costante (K, che, nel caso specifico, è
numericamente 800) e non c’era certo bisogno di
ulteriori complicazioni logaritmiche.
L’acido carbonico, poi, non è altro che una CO2 disciolta in acqua
(CO2 + H2O = H2CO3) e presenta una
relazione perfettamente lineare con la pressione dell’Anidride Carbonica (pCO2)
cioè “più aumenta la pressione della CO2 più quest’ultima si discioglie
nell’acqua stessa e forma acido carbonico”.
Per questi motivi l’equazione di Henderson può essere espressa anche in un altro
modo, sostituendo al numeratore l’ acido carbonico con la pCO2, come fu
genialmente proposto da Kassirer [12]dando
origine alla definitiva Equazione di Henderson-Kassirer che è la più semplice da
utilizzare (Formula 2):
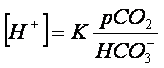
Essa, infatti, ci consente di passare dalla chimica (spesso antipatica) alla clinica (a noi più congeniale). Considerato, infatti, che a regolare la pressione dell’anidride carbonica è deputato prevalentemente il polmone ed a regolare la concentrazione del bicarbonato è deputato prevalentemente il rene, possiamo concludere che la concentrazione degli Idrogenioni è la risultante del rapporto fra la funzione del polmone e la funzione del rene (Fig. 1).
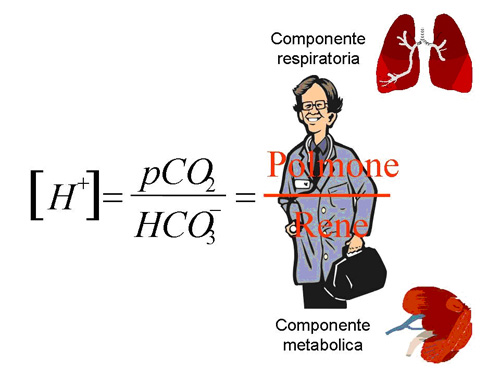
Figura 1 – La concentrazione degli idrogenioni è la risultante del rapporto tra
la funzione polmonare e quella renale
Questa immagine ci semplifica la memorizzazione della formula ed è semplice richiamare alla mente che il polmone sta al di sopra del diaframma (linea della frazione) ed il rene sta al di sotto di esso, il che corrisponde al contenuto della formula 2.
In condizioni patologiche questo equilibrio si può rompere e si hanno le alterazioni acido-base, isolate o miste. Per esempio, se aumenta la pCO2, per una patologia polmonare, si avrà un aumento degli idrogenioni e quindi una acidosi di origine respiratoria; se diminuisce la pCO2 diminuiscono gli idrogenioni e si avrà una alcalosi respiratoria.
Se diminuiscono i bicarbonati (al denominatore) si avrà un aumento degli idrogenioni liberi e, di conseguenza, una acidosi di origine metabolica; se aumentano i bicarbonati, diminuiscono gli idrogenioni liberi e si avrà una alcalosi metabolica.
Quando il disturbo primario è respiratorio scatta il meccanismo di compenso metabolico del rene, che interviene regolando la escrezione di ioni idrogeno ed aumentando il riassorbimento dei bicarbonati.
Quando il disturbo primario è metabolico scatta il meccanismo di compenso respiratorio dei polmoni che, con l’iperventilazione , regola la fuoriuscita di CO2. (13, 14, 15, 16, 17). (Figura 2)
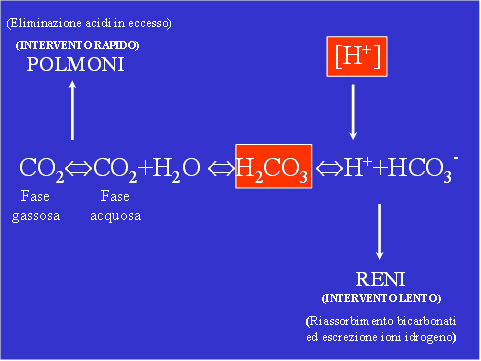
Figura 2 – Lo schema fondamentale dell’ equilibrio acido-base
La sottostante figura 3, lo immagina come una bilancia in equilibrio ma il senso non cambia; miscelando 1 parte di H2CO3 e 20 parti di bicarbonato si ottiene la condizione normale, con la concentrazione idrogenionica uguale a 40 nanoEq / Litro (e il pH uguale a 7,40).
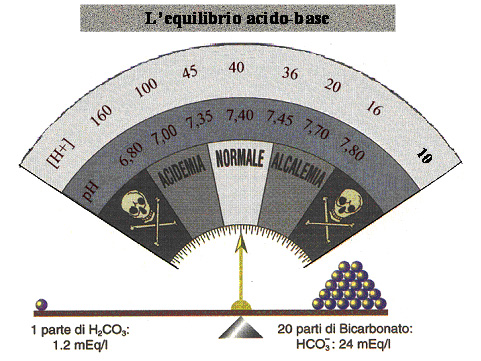
FIG. 3 - La bilancia dell’equilibrio acido-base
Come dice Luciano de Crescenzo: “l’equilibrio deve essere inteso in questo modo: la doccia ha due manopole, una per l’acqua calda e una per l’acqua fredda. Manovrando, ora l’una ora l’altra, è possibile ottenere la giusta temperatura”. (18)
L’ EQUILIBRIO IDRO-ELETTROLITICO (o IONICO)
L’equilibrio ionico si fonda essenzialmente sul principio di elettroneutralità, secondo il quale nel nostro organismo, in ogni istante, dobbiamo avere una situazione di elettroneutralità, cioè la somma dei cationi (sostanze a carica positiva) deve essere sempre uguale alla somma degli anioni (sostanze a carica negativa) anche se qualche singolo componente di essi può cambiare temporaneamente la sua concentrazione.
Spesso si fa confusione sul concetto di “elettroneutralità”, che non deve essere frainteso con quello di “neutralità” utilizzato dal punto di vista acido-base.
Nell’ equilibrio acido-base (E.A.B.), convenzionalmente, si intende per “neutralità” la presenza di un pH = 7, cioè né acido né basico, bensì neutro (diverso, poi, dal pH normale o fisiologico, che è pari a 7.4, cioè tendenzialmente basico (o alcalino).
Con il termine di “elettroneutralità”, invece, si intende che le cariche negative (anioni = a privativa, senza ioni) devono essere controbilanciate da un pari numero di cariche positive (cationi), in modo da annullarsi scambievolmente dal punto di vista ionico.
La composizione ionica normale è diversa tra liquido intracellulare (L.I.C.) e liquido extracellulare (L.E.C.) ed esistono ulteriori differenze, nel contesto dello stesso L.E.C., tra plasma e liquido interstiziale.
Noi, nella nostra relazione faremo riferimento alla situazione del plasma o del siero, perché, nel curare i nostri pazienti nella pratica clinica, dobbiamo basarci per forza solo su quegli elementi che sono gli unici facilmente ottenibili e misurabili.
La normale composizione del liquido extracellulare plasmatico ed il principio di elettroneutralà vengono espressi chiaramente nello ionogramma di Gamble del 1938 (Fig. 4) e nella Tab. 1 (19, 20, 21).
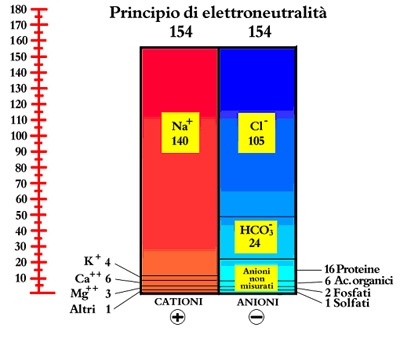
FIG 4 - Principio di elettroneutralità. Ionogramma di Gamble
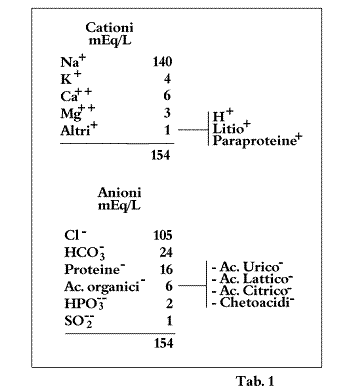
Tab. 1 - Valori numerici dello ionogramma di Gamble
Dalla Tabella 1 si evince chiaramente che la somma dei cationi (Na+ + K+ + Ca++ + Mg++ + Altri ) corrisponde a 154 mEq/L e la somma degli anioni (Cloro + Bicarbonati + Proteine + Fosfati + Solfati + Acidi Organici) raggiunge lo stesso valore totale di 154 (questo è il motivo per cui la classica Soluzione Fisiologica, utilizzata comunemente nella pratica clinica, è fatta in modo da contenere 9 gr di Cloruro di Sodio per ogni litro, perché in tal modo si hanno 154 mEq di Na e 154 mEq di Cloro).
Esprimendo il contenuto in grammi (e non in mEq) un litro di soluzione fisiologica contiene 3,568 grammi di Sodio (Na+) e 5,432 grammi di Cloro (Cl-), pertanto, questa quota di liquidi (1 Litro) apporta una quantità di Sodio ampiamente sufficiente al fabbisogno giornaliero che si aggira intorno ai 3 gr /die, reperibili in 5-6 gr. di Cloruro di sodio (Sale da cucina).
In pratica quello che conta di più nella classica Soluzione Fisiologica è che essa sia isotonica (o iso-osmotica); la sua osmolalità, infatti, è 308 mOsmoli / Litro, cioè corrispondente quasi a quella normale plasmatica che oscilla tra 290 e 295 mOsm / Litro.
Nello stesso tempo, però, se sottoponiamo ad analisi le Soluzioni fisiologiche comunemente utilizzate nel nostro reparto, per conoscerne il pH , possiamo scoprire con grande sorpresa che esso oscilla da valori di 4,5 fino a valori di 7,0 mentre non troveremo mai un valore di pH di 7,40 pari o vicino a quello fisiologico.
Possiamo affermare, quindi, che l’utilizzo della Soluzione
“normale”, cosiddetta Fisiologica, rispetta sia il principio della
elettro-neutralità che quello della iso-osmolalità, mentre non rispecchia il
principio della neutralità acido-base, per cui “non è perfettamente fisiologica”
almeno dal punto di vista acido-base.
Normalmente tutti i cationi esistenti nel plasma potrebbero essere misurati, ma,
nella pratica clinica routinaria, vengono dosati generalmente solo il Na e il K,
i quali esprimono il 94% di tutti i cationi presenti nel LEC.
Gli anioni, presenti nella colonna di dx, invece, vengono comunemente trascurati in toto. Nel nostro stesso reparto è uno sforzo continuo convincere definitivamente tutti gli infermieri, in particolare quelli più anziani, che, quando richiediamo “gli elettroliti”, intendiamo dire, almeno Sodio, Potassio e Cloro.
Immancabilmente si corre il rischio che il Cloro venga omesso nella richiesta, se non abbiamo avuto l’attenzione di indicarlo specificamente (“mi raccomando, con gli elettroliti, anche il Cloro”!).
Per qualche motivo inconscio esso deve essere antipatico a tutti, per cui si tende ad attuare la rimozione involontaria o volontaria. Eppure, come vedremo, il Cloro è molto importante, non fosse altro perché rappresenta l’elettrolita quantitativamente più significativo tra gli anioni ed, insieme ai Bicarbonati, esprime l’84% di tutti gli anioni presenti nel LEC.
Per tale motivo il Cloro dovrebbe rientrare più spesso nella routine diagnostica di laboratorio e, qualora venissero frapposte questioni di costi, si può tranquillamente, in cambio, eliminare l’azotemia, considerando l’utilizzo ormai routinario della creatininemia.
Il Bicarbonato, poi, comunemente non viene misurato mai, tranne quando si effettua una emogasanalisi.
E’ bene ricordare, però, che, anche durante l’esame emogasanalitico esso non viene misurato, bensì viene solo “calcolato” in base alla equazione di Henderson, ricavandolo con il calcolo matematico effettuato automaticamente dagli apparecchi in dotazione.
Gli altri anioni (i fosfati, i solfati, gli ac.organici e le proteine) non vengono dosati comunemente e, nella pratica clinica corrente, non è necessario dosarli tutti, oltre al fatto che sarebbe indaginoso e costoso farlo sempre. In definitiva, quindi, routinariamente, lo studio della configurazione ionica del plasma viene limitata in genere al sodio e al potassio (come cationi) ed al cloro ed al bicarbonato (come anioni).
L’ EQUILIBRIO OSMOLARE
In un uomo normale, dal peso corporeo totale di 70 Kg., l’acqua ne rappresenta il 60% (42 litri), distribuita per il 40% nel compartimento intracellulare (L.I.C., 28 Litri) e per il 20% nel compartimento extracellulare (L.E.C., 14 Litri).
La composizione chimica del LEC mostra una netta prevalenza del Na+ (140 mEq/L) e del Cloro (105 mEq/L) con i Bicarbonati (24 mEq/Litro) e il Glucosio (90 mg %), mentre nel liquido intracellulare è nettamente predominante il K+ (140 mEq/L) con i Fosfati (95 mEq/L), il Magnesio (58 mEq/L) e le Proteine (40 mEq/Litro).
Questa particolare distribuzione degli elettroliti, con la consistente ricchezza di Na+ nel LEC, ha fatto nascere l’arguta osservazione che “le cellule contengono acqua dolce e sono immerse in un mare di acqua salata”.(22, 23). Il LIC è dolce ed il LEC è salato.
In questo sistema l’acqua passa liberamente dallo scompartimento intracellulare a quello extracellulare ( o viceversa) in base alle variazioni della pressione osmotica, fino a raggiungere l’equilibrio, perché, per il principio della iso-osmolalità, nel soggetto normale, la osmolalità endocellulare e la osmolalità extracellulare debbono essere perfettamente uguali; questo riequilibrio può avvenire grazie alle proprietà della membrana cellulare, che è permeabile liberamente all’acqua, mentre non è permeabile liberamente al Sodio. (Fig. 5)
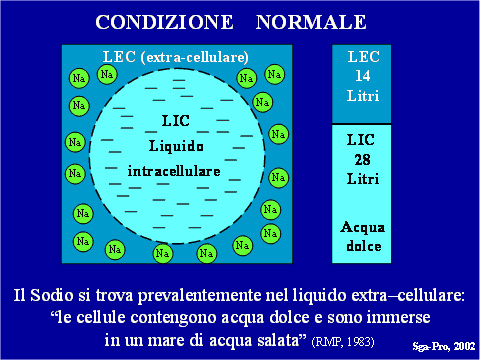
Figura 5 – Rapporti tra liquido intracellulare (LIC) ed extracellulare (LEC)
L’osmolalità esprime la concentrazione di sostanze osmoticamente attive (osmoli) presenti in 1 Litro di acqua.
Essa può essere calcolata con una semplice formula o può essere misurata con l’osmometro, che valuta il punto di congelamento del plasma o della soluzione, in base al principio che il punto di congelamento diminuisce in funzione della concentrazione delle osmoli, cioè è tanto più basso quanto maggiore è la concentrazione del soluto presente.
L’osmolalità “misurata” con l’osmometro è, normalmente, più o meno uguale a
quella “calcolata”, che si può ottenere con la seguente formula:
La concentrazione del Na viene moltiplicata per 2, perché bisogna tener conto anche degli anioni che comunemente sono associati al Na e l’accompagnano, quali per es. il Cloro o il Bicarbonato.
L’effetto osmotico esercitato da una mole di Cloruro di Sodio è, infatti, doppio (2 osmoli) in quanto il Sodio e il Cloro si dissociano (e altrettanto vale per il Bicarbonato di Sodio).
Da quanto detto se ne deduce chiaramente che nel LEC la pressione osmotica è determinata, in massima parte, dal Na+ che ha un forte “potere osmotico”, per cui in una soluzione si comporta come una sostanza “osmoticamente attiva”, capace cioè di attirare acqua e trattenerla, e proprio per questa sua prevalente funzione esso viene definito: “lo scheletro osmotico dell’organismo”.
La quantità assoluta di sodio presente nel LEC ne regola lo stato di idratazione, facendo sì che per ogni 140 mEq si accumuli 1 litro di acqua.
In termini di osmolalità, quindi, di tutte le complessive 290 mOsm/Kg presenti nel LEC, almeno 280 mOsm sono dovute al sodio ed ai suoi principali anioni (Cloro o Bicarbonato), per cui normalmente i sali di sodio rappresentano più del 95% dell’osmolalità totale.
Quando aumenta la pressione osmotica nel LEC (per es. per aumento del sodio ivi presente) si assiste ad un immediato spostamento dell’acqua dal LIC al LEC, lungo il gradiente di concentrazione creato dall’osmolalità aumentata, per cui si determina una disidratazione intra-cellulare con conseguente raggrinzimento e sofferenza cellulare. (Fig. 6)
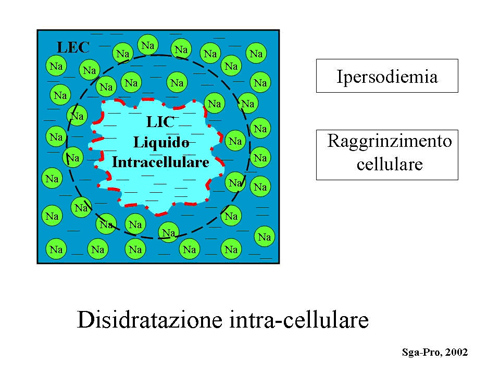
Figura 6 – Eccesso di Sodio nel liquido extracellulare (LEC) con raggrinzimento della cellula.
Il passaggio inverso avviene qualora si verifichi una diminuzione del Na+ nel LEC, il che comporta una migrazione dell’acqua verso il LIC per ristabilire la normale osmolalità e il normale equilibrio tra LIC e LEC, con conseguente rigonfiamento ed analoga sofferenza cellulare. (Fig. 7)
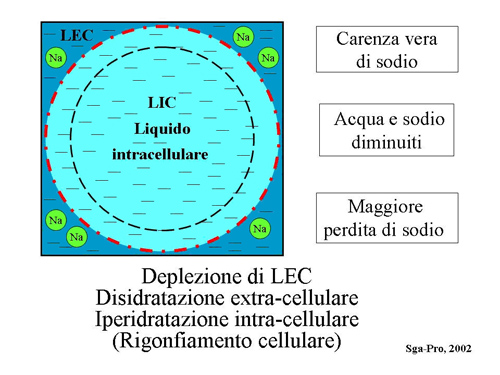
Fig. 7 - Carenza di Sodio nel liquido extracellulare (LEC) e conseguente rigonfiamento cellulare
In pratica l’osmolalità del LEC, dovuta in particolar modo al Na+, condiziona il volume di acqua nel LIC e di conseguenza incide significativamente sui volumi e sulla funzionalità delle cellule, a causa dell’ingrandimento o dell’impicciolimento delle stesse cellule.
Ne consegue, intuitivamente, quanto sia importante mantenere la concentrazione del Sodio nei limiti della normalità.
Un uomo normale di 70 Kg. necessita di 5-6 grammi di sale (NaCl) al giorno, mentre con la dieta in Europa se ne consumano, mediamente, 12 grammi, e queste abitudini, in persone predisposte, possono portare all’insorgenza di ritenzione idrica.
È utile chiarire subito che, nell’esposizione dei dati numerici, bisogna fare attenzione a non confondere il solo sodio (Na+) con il sale comune (cloruro di sodio / NaCl) ed occorre ricordare che 1 grammo di sodio si trova in 2,5 grammi di Sale cloruro.
Ovviamente il sodio viene introdotto sia sotto forma di sale, contenuto naturalmente negli alimenti, sia come sale da cucina (cloruro di sodio), di cui esso rappresenta solo il 40% del peso (l’altro 60% è dato dal cloro), per cui, volendo esprimerci in termini pratici, un soggetto normale europeo introduce con la consueta dieta dai 7,5 ai 15 gr. di sale sodico, prevalentemente sotto forma di cloruro di sodio.
Per praticità conviene memorizzare che un cucchiaio raso da minestra contiene circa 15 gr. di sale e circa 10,5 gr. di zucchero, un cucchiaino raso da caffè contiene circa 7,5 gr. di sale (più che sufficiente come dose totale quotidiana) e circa 6,5 gr. di zucchero.
Un litro di soluzione fisiologica, come già abbiamo detto) contiene la quantità di sale ampiamente sufficiente al fabbisogno giornaliero (5-6 gr.) ed, in pratica, quello che conta di più è che essa sia isotonica (o iso-osmotica); la sua osmolalità, infatti, è 308 mOsmoli / Litro, cioè corrispondente quasi a quella normale plasmatica che oscilla tra 290 e 295 mOsm.
La parola “isotonica” esprime quella condizione in cui due soluzioni hanno concentrazioni dei soluti e pressioni osmotiche uguali o costanti, per cui iso-tonico ed iso-osmotico sono sinonimi (iso= prefissi per indicare “uguale”).
Anche la classica soluzione glucosata al 5% è iso-tonica all’origine (pOsm = 278) ma, appena essa penetra nel plasma, lo zucchero viene subito utilizzato dal metabolismo cellulare, per cui la soluzione glucosata diventa praticamente acqua naturale distillata e quindi “ipotonica” rispetto al plasma (capace, cioè, di abbassare la osmolalità e la sodiemia plasmatica).
Questo è il motivo per cui, spesso, l’infusione di soluzioni glucosate in eccesso è responsabile di gravi condizioni cliniche di iposodiemia.
Normalmente l’eliminazione giornaliera del sodio introdotto (con la dieta o per via infusionale) avviene per via renale ed extrarenale (feci, sudore, etc.). L’eliminazione per via renale è in dipendenza dell’introito ed oscilla dai 100 ai 250 mEq/die; l’eliminazione extrarenale è nell’ordine dei 20-25 mEq/die.
Il rene ha la grande capacità di riconoscere se con la dieta abbiamo introdotto 10, 100 o 1000 mEq di sodio. Se sono stati introitati 10 gr. di sodio in eccesso, nel giro di tre ore, con un sistema renale che sia normalmente funzionante, essi saranno eliminati mediante una equivalente eliminazione del Na urinario.
Al contrario, un diminuito apporto di sodio comporta una equivalente diminuzione del sodio urinario: l’80 – 82% del sodio filtrato a livello glomerulare viene riassorbito già nei tubuli prossimali ed il 18 – 20% si riassorbe in quelli distali.
Tutte le variazioni della filtrazione glomerulare possono essere compensate dal riassorbimento tubulare, per cui esiste un equilibrio tubulo – glomerulare.
Il rene, grazie al sistema di concentrazione cortico-papillare e, soprattutto, grazie alla branca ascendente dell’ansa di Henle, è l’unico organo capace di separare il sodio dall’acqua.
In virtù di questa qualità il rene è l’unico organo capace di variare le reciproche concentrazioni fra sodio e acqua, modificandole rispetto alle consuete concentrazioni esistenti nel plasma. La separazione dell’acqua dagli elettroliti avviene nella porzione spessa dell’ansa di Henle, che è impermeabile all’acqua, per effetto di una pompa elettrogena del Cloro.
Questo equilibrio può apparire semplice, ma in effetti, il mantenimento dell’osmolalità, della sodiemia e dell’acqua nelle condizioni normali è un processo complesso che vede in causa molti attori: l’ormone antidiuretico (ADH), la sete, l’aldosterone (o meglio il sistema renina-angiotensina-aldosterone, S.R.A.A) ed i peptidi natriuretici, atriale (ANP) e cerebrale (BNP). (Fig. 8) (24, 25, 26, 27, 28, 29, 30)
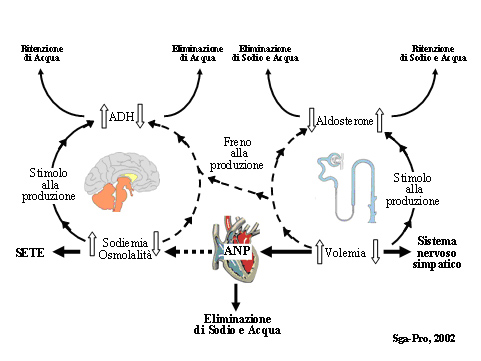
Fig. 8 - Il complesso sistema di rapporti esistenti fra l’equilibrio del sodio, la osmolalità e la volemia, regolati dai tre sistemi endocrini del Cervello (mediante l’ormone antidiuretico - ADH) del Rene (mediante il sistema Renina Angiotensina Aldosterone – S.R.A.A.) ed il Cuore (mediante i fattori natriuretici – ANP e BNP)
LE INTERRELAZIONI ESISTENTI TRA I TRE EQUILIBRI
In definitiva, per mantenere costante il “milieu interieur” di Claude Bernard è indispensabile che, in qualsiasi istante, siano conservate le interrelazioni normalmente esistenti tra i tre equilibri (ionico, acido-base ed osmolare) espressi graficamente nella Fig. 9, che consente di acquisire alcune informazioni utilissime sia nella Fisiologia che nella Patologia.
L’archiviazione in memoria di questa immagine, infatti, può ritornare molto utile nella pratica clinica quotidiana e non può mancare nel bagaglio culturale di fondo del medico clinico.
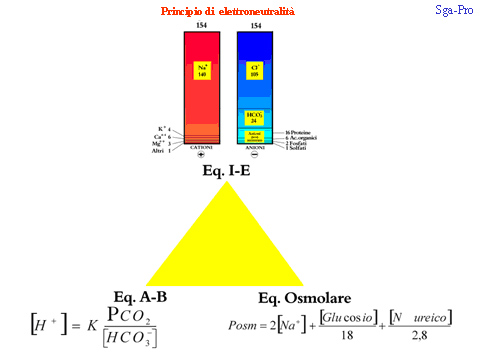
Fig. 9 - La sintesi delle interrelazioni esistenti fra i tre sistemi: equilibrio acido-base, equilibrio idro-elettrolitico ed equilibrio osmolare (cosiddetta “volgare fondamentale trinità”).
La semplice analisi di questa figura, infatti, fa addivenire ad alcune banali conclusioni, utilissime sia nella Fisiologia che nella Patologia, che cercheremo di evidenziare ed enumerare:
1) Esistono connessioni evidenti fra l’equilibrio acido-base e quello idro-elettrolitico, i quali presentano alcuni elementi strettamente in comune, quali i bicarbonati (rinvenibili, tra gli anioni, nella colonna blu di destra dello ionogramma di Gamble, ed altrettanto presenti al denominatore nella equazione di Henderson); modificazioni di questo anione, ovviamente, si riflettono in entrambi i sistemi.
Apparentemente, poi, osservando anche attentamente la
figura, sembrerebbe che non ci siano altri elementi di collegamento, ma
non bisogna trascurare che nella colonna rossa di sinistra, tra i cationi, sotto
la voce “altri”, si possono reperire proprio gli idrogenioni (Tab. 1), i quali
sono presenti, ovviamente, anche nella equazione di Henderson.
Questa incredibile scoperta ci fa meditare su una delle più importanti evidenze di fisio-patologia nella vita dell’uomo: gli idrogenioni, cioè, sono presenti in una quantità ridottissima (appena 40 nanoEquivalenti per Litro, in confronto ai 140 milliEquivalenti per Litro del Sodio) ovverosia sono presenti nell’ordine di grandezza di circa 3 milioni di volte inferiori rispetto alla concentrazione del Sodio (praticamente Davide e Golia).
Ciononostante essi sono indispensabili per il mantenimento della vita e possono metterla in discussione anche con piccolissime variazioni della loro concentrazione (per esempio, nell’ordine di soli 50 nanoEquivalenti).
Il fatto che, fin’ora, avevamo pensato agli idrogenioni sempre in termini di pH (e mai in termini assoluti) ci aveva fatto perdere di vista l’unità di misura ed il termine di riferimento e, di conseguenza, ce ne aveva fatto sottovalutare la loro immensa importanza ai fini della sopravvivenza.
Ne consegue, alla luce di questa nuova più realistica visione, che a buon diritto, l’equilibrio acido-base può essere definito l’equilibrio degli equilibri perché, alla fine di tutte le attività metaboliche, è quello che mantiene nella norma le funzioni più vitali, rimanendo in uno strettissimo range fisiologico.
2) Esiste una connessione evidente fra l’equilibrio osmolare e quello idro-elettrolitico, i quali presentano un elemento strettamente in comune, quale il Sodio, presente tra i cationi, nella colonna rossa di sinistra dello ionogramma di Gamble, e rinvenibile anche nella formula della osmolalità, in cui anzi viene moltiplicato per due.
Qualsiasi modifica di tale catione si rifletterà, intuitivamente e direttamente, in entrambi i sistemi, e, anzi, nell’equilibrio osmolare la variazione del Sodio inciderà al doppio, per cui sue variazioni, non influenti significativamente sull’equilibrio ionico, possono avere importanza maggiore nell’equilibrio osmolare.
Il Sodio della formula della osmolalità, poi, è presente nel plasma sia sotto forma di Cloruro di sodio che di Bicarbonato di Sodio, per cui si possono intuire gli ulteriori rapporti esistenti tra l’Equilibrio osmolare e quello idro-elettrolitico, facendo riferimento visivo alla colonna dx. degli anioni.
Se diminuiscono i Bicarbonati, per es., devono per forza aumentare gli altri anioni onde rispettare la elettroneutralità ed, in genere, aumenta il Cloro. Per tale motivo Cloro e Bicarbonati sono strettamente interconnessi e la loro somma rimane costante (se aumenta l’uno, diminuisce l’altro e viceversa, con un rapporto di 1 a 1); se invece il Cloro e i Bicarbonati sono diminuiti entrambi, questo ci fa capire che esiste un patologico aumento di qualche altro anione non misurato, presente nella colonna di dx (17, 18).
Ne derivano, di conseguenza, alcune regole mnemoniche e pratiche per orientarsi nel labirinto degli equilibri e delle loro patologie.
Primo esempio: In caso di diarrea acuta, in cui si può avere una eccessiva perdita di Bicarbonati attraverso l’intestino, il Cloro, come abbiamo detto, aumenterà di conseguenza, perché è l'anione che viene normalmente scambiato con l'anione Bicarbonato con un rapporto 1:1.
La loro somma non deve variare (per rispettare la elettroneutralità) e alla ipo-bicarbonatemia corrisponderà una ipercloremia.
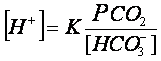
si può facilmente intuire che la diminuzione dei Bicarbonati al denominatore farà si che aumentino gli idrogenioni [H+] e quindi si generi una acidosi.
Questa perdita netta di Bicarbonati non può essere rimpiazzata dall’organismo in tempi rapidi, perché in questo caso il recupero naturale dei bicarbonati può avvenire solamente per generazione dei “nuovi” bicarbonati renali. Considerato che questo meccanismo renale è lento e richiede molte ore o/e anche giorni per divenire ottimale, è indispensabile che (se la bicarbonatemia è inferiore a 15 mEq/Litro, livello limite di allarme), si provveda, frattanto, a rimpiazzarne la carenza con alcalinizzanti esogeni (Bicarbonati di Na) per riportare in equilibrio il sistema acido-base.
Tutto ciò fa “guadagnare tempo” nell’attesa del compenso naturale renale, ma anche per aspettare l’effetto della terapia causale e sintomatica, ovviamente instaurata, e volta ad eliminare anche l’eziologia scatenante della diarrea.
Somministrando Bicarbonato di Sodio vengono infuse parti bilanciate di cationi (Na) e anioni (Bicarbonati), per cui è vero che la elettroneutralità ionica non viene compromessa, ma bisogna sempre tener conto che il Na ha una grande responsabilità nell’equilibrio osmolare e, inevitabilmente, nel mantenimento della volemia.
Di conseguenza, un suo aumento può far aumentare la volemia con tutte le ripercussioni sul circolo o sull’apparato cardio-circolatorio, di cui bisogna sempre tener ben conto nella visione globale. (Fig. 8)
Secondo esempio clinico molto comune e calzante, nel senso inverso, è il caso di un paziente con vomito “gastrico” persistente, che, quindi, perde molto acido cloridrico (H+ e Cloro-).
Per lo stesso meccanismo precedente, ma all’inverso, la perdita di Cloro verrà rimpiazzata da una corrispondente quantità di ioni Bicarbonato (con un rapporto 1:1).
La perdita di idrogenioni e l’aumento dei bicarbonati faranno emergere una alcalosi metabolica con ipocloremia. In questi casi la terapia prevede la somministrazione di Cloruro di Na (soluzione fisiologica) che ha duplice funzione di reintegrare le perdite di Cloro e, contemporaneamente, di correggere il deficit di volume.
Anche in questo caso, somministrando soluzione fisiologica vengono infuse parti bilanciate di cationi (Na+) e anioni (Cl-) senza alterare le elettroneutralità sierica tra anioni e cationi, ma la normalizzazione del Cloro all’interno della colonna degli anioni farà diminuire i Bicarbonati che dovranno lasciare il loro posto, rinormalizzando, così, la situazione di alcalosi che si era determinata. (31, 32, 33, 34, 35, 36, 37, 38, 39, 40)
3) A prima vista tra equilibrio acido-base ed equilibrio osmolare (alla base del triangolo della fig. 9) sembra che non ci sia alcun collegamento ed, infatti, non si intravedono punti di contatto tra le due formule.
Ma, meditando con più attenzione, emerge, come già abbiamo detto, che il Bicarbonato (HCO3-) è presente nel plasma sia sotto forma di Acido carbonico (H2CO3) che nelle vesti di Bicarbonato di sodio (NaHCO3), per cui, in quest’ultima forma, a causa del Sodio, ha sicure interferenze con la osmolalità, realizzando punti di collegamento tra i due sistemi.
In terapia, poi, quando si somministrano Bicarbonati (per os o per via endovenosa) bisogna sempre ricordare che si sta somministrando anche Sodio (le formulazioni esistenti in commercio sono di Bicarbonato di Sodio) e, quindi, bisogna tener conto che non si va ad interferire solo sull’equilibrio acido-base (correggendo l’acidosi) ma anche su quello osmolare (aumentando la osmolalità) e su quello ionico (cambiando la composizione dei cationi della colonna rossa di sin. dello ionogramma di Gamble).
Se in queste colonne aumenta o diminuisce qualche componente, qualche altro deve diminuire od aumentare in maniera corrispondente all’interno della stessa colonna, inevitabilmente.
Se in quella di sinistra dei cationi, per esempio, aumenta la quota del Sodio, al suo posto deve diminuire un altro catione (per es. il Ca+ o il K+) e così anche nelle altre eventualità analoghe.
Queste colonne richiamano tristemente alla mente le due, ormai famose e storiche, torri gemelle (twin towers) di New York, che ci invitano a tenere sempre in debito conto il concetto di equilibrio (anche mondiale) che deve essere sempre salvaguardato per non fare crollare il sistema.
IL CONTROLLO DELLA VOLEMIA: UNO DEI FONDAMENTALI DELLA MEDICINA
Come abbiamo più volte ripetuto (e mai a sufficienza) l’altro elemento importante che incide in modo sostanziale sul mantenimento dell’omeostasi generale è il “volume efficace di sangue arterioso (VESA)” o “volemia efficace”.
Con questo termine non si intende tutto il volume totale di sangue circolante, ma solamente quella piccola parte del volume ematico circolante (circa il 15%), che riempie il letto vascolare dei grossi vasi intratoracici ed addominali, da cui dipende l’attivazione dei cosiddetti “recettori del volume”, che verificano lo “stato di ripienezza” dei vasi circolatori e regolano il precarico cardiaco.
Al contrario, il volume totale del sangue circolante non esprime realmente la volemia efficace, perché anche se si ha una grande quantità di sangue a disposizione (ma questo sangue rimane nel territorio venoso) il VESA è ridotto (ed è questa riduzione, in definitiva, che realmente conta negativamente ai fini della efficacia).
Il volume trattenuto, per esempio, nel cosiddetto “terzo spazio”, sotto forma di ascite o di edema, sequestrato nel distretto splancnico e nelle parti declivi (arti inferiori, regioni sacrali, etc…), non risulta utile perché non contribuisce alla “volemia efficace”, pur facendo parte dei liquidi extracellulari (ne consegue che i volumi totali possono anche essere aumentati, ma non sono efficaci).
Gli eventi che possono essere ipovolemizzanti sono numerosi: l’emorragia, la diuresi eccessiva, la diarrea abbondante, il vomito, la febbre, la sudorazione profusa, la paracentesi evacuativa, etc…
A livello renale una insufficiente perfusione ematica determina una bassa escrezione urinaria di sodio, perché il rene ipoperfuso riassorbe avidamente quasi tutto il sodio e l’acqua filtrati, al fine di ripristinare la normale volemia.
Tutto ciò avviene grazie all’attivazione del sistema Renina-Angiotensina-Aldosterone, inibito o innescato dalla volemia efficace, la quale costituisce il fattore determinante dell’eliminazione o del riassorbimento renale del sodio.
Quando la volemia aumenta viene frenata la produzione di Aldosterone (il che porterà ad una eliminazione di sodio + acqua) e viene anche stimolata, (mediante la distensione cardiaca atriale), la produzione del Peptide Natriuretico Atriale (ANP) che ulteriormente farà aumentare l’eliminazione di sodio e acqua. (Fig. 8)
Un dato molto importante, infatti, di cui spesso non si tiene conto, è che la sodiemia e la volemia non sono sempre direttamente correlate. Istintivamente, infatti, siamo portati a fare l’associazione mentale tra ipersodiemia e ipervolemia, oppure tra iposodiemia ed ipovolemia. Ed, invece, quasi sempre, non è così, anzi spesso è il contrario.
Come abbiamo visto, la regolazione della sodiemia (o della osmolalità) da un lato e la regolazione dei volumi circolanti dall’altro, seguono vie fisio-patologiche diverse [27]
L’osmoregolazione è controllata dall’ADH e dalla sete, che agiscono esclusivamente sull’acqua, mentre la regolazione dei volumi circolanti è coordinata dal SRAA, dall’ANP e dal Sistema Nervoso Simpatico, che agiscono sul Sodio e sull’Acqua (Fig. 8).
Per esempio, se si ha una perdita di liquido ipotonico
(come nell’eccessiva sudorazione dei maratoneti o nelle diarree acquose
abbondanti) vi può essere una eliminazione di molta acqua con la perdita di una
minore quantità di sale rispetto al plasma.
Di conseguenza, in questi casi, la volemia efficace diminuisce per effetto della
perdita dei liquidi (ipovolemia), mentre la sodiemia, invece di diminuire,
aumenterà per effetto della emoconcentrazione (ipernatriemia). In questi casi
di ipersodiemia con diminuzione del volume plasmatico circolante (ipovolemia
ipersodiemica) il primo obiettivo terapeutico deve essere il ripristino del
volume circolante: la volemia viene sempre prima della sodiemia.
L’ipovolemia e il possibile conseguente shock ipovolemico, infatti, mettono il paziente in pericolo di vita. (41, 42, 43, 44, 45)
Altro esempio chiarificatore della mancata correlazione fra Volemia e Sodiemia è quello dei pazienti con eccessiva secrezione di ormone antidiuretico, che produrrà una ritenzione di acqua con aumento della volemia e calo della sodiemia per effetto della diluizione.
Questi due semplici esempi dimostrano con facile evidenza che la sodiemia non permette di valutare il volume del LEC, perché Osmolalità e Volemia non sempre vanno nella stessa direzione, come si è portati a pensare..
Analizzando queste interconnessioni, sempre più ci si rende conto che il corpo umano è un “insieme inscindibile” e che i singoli apparati, pur nobili nella loro specifica identità, concorrono solo ad un fine supremo in cui ognuno di loro perde la sua autonoma individualità.
Sono proprio queste tematiche a convincerci che l’Olismo in Medicina non è una parola astratta, né una vacua visione “platonica”, nè “la fissazione di alcuni medici all’antica, ormai in estinzione”. L’ olismo dei nostri padri, da non confondere con quello delle “medicine alternative”, è fondato su solide basi scientifico-chimico-matematiche e non solo su basi ideali-filosofiche e rappresenta una concreta realtà ineludibile con cui bisogna fare i conti, i-ne-vi-ta-bil-mente, tutti i giorni nella pratica medica.
Mettendo insieme gli elementi della Fig. 8 (equilibrio idro-elettrolitico, acido-base ed osmolare) con quelli della Fig 8 (neuroendocrino, endocrino renale ed endocrino cardiaco), combinati insieme alla formula di Loeb, si può ottenere una unica immagine mnemonica finale, rappresentata dalla Fig. 10.
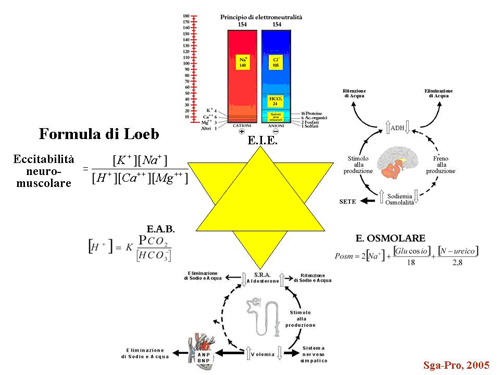
Fig. 10 - Sintesi finale delle interrelazioni ineludibili in Medicina
Guardando questa Figura, non si può non convenire che i singoli componenti sono integrati in un vortice di interconnessioni evidentissime ed innegabili, cui non si può non fare riferimento mentale ogni qual volta si vada ad impostare una terapia ragionata.
Solo così si potrà essere quanto più razionali possibili ed evitare al massimo gli errori sempre possibili per la grande complessità del sistema che è, indiscutibilmente, troppo perfetto.
Talmente perfetto, che potremmo dirlo “divino”.
Henderson L J diceva: ““I believe very strongly that the universe has alwais possessed a structure and was never chaotic”. A noi Medici tocca proteggerlo, nel nostro piccolo.
CONCLUSIONI
Lo studio degli Equilibri deve per forza rappresentare un “fondamentale” nella
cultura medica ed è uno dei principi unificanti nella formazione generale in
Medicina, che sempre più è orientata alla cura delle patologie gravi nei
pazienti critici, pluripatologici e, come tali, complessi, per cui meritevoli di
una visione olistica, allargata a 360 gradi e forse anche oltre, non solo in
senso orizzontale ma anche in altre dimensioni (“verticali”).
Nella nostra attività lavorativa quotidiana di Medici, non c’è nulla di quello che facciamo routinariamente che non incida o non interferisca su queste materie e queste considerazioni fanno sì che questo tema sia un argomento di cui dobbiamo occuparci per forza.
Esso è praticamente ineludibile, a meno che non vogliamo auto-ingannarci od auto-illuderci.,
Proprio questi tipo di Pazienti complessi è più meritevole di una cultura attenta a queste problematiche “sistemiche”, che in definitiva rappresentano il nocciolo della visione olistica e della mentalità tipicamente internistica.
Ogni singolo caso clinico, infatti, è un piccolo esperimento, dove vengono messe a dura prova le nostre capacità diagnostiche e terapeutiche, ed in ogni terapia bisogna trovare la giusta rotta tra Scilla e Cariddi, tra i possibili benefici ed i potenziali rischi attuali e futuri, cosicchè, in questi casi, si esalta il valore ed il piacere della Medicina Interna..
Tutta questa complessa problematica viene sviscerata ogni giorno nelle corsie, anche se spesso i profani non se ne accorgono e “vivono tranquilli” (beati loro), perché il bello della “non conoscenza” dei problemi sta proprio in questo, che molti ritengono che i pazienti muoiano “per cause imprecisate o per arresto cardio-circolatorio” e non per squilibri idro-elettrolitici, acido-base, osmolari e/o volemici.
La chiave del problema, invece, è nel saper ritrovare la miscela appropriata di tali ioni o meglio “l’insieme armonioso” dei vari sali nelle giuste concentrazioni, tali da mantenere le condizioni vitali
E non fa niente che poi “nessuno se ne accorge”, tranne il Malato, perché in fondo si è messo in opera la propria professionalità, magari solo modificando le dosi ed i tempi di infusione (cose che in genere non fanno scalpore, ma che esprimono (per chi è competente) la sintesi della esperienza, della cultura, della prudenza e, quindi, della razionalità dell’Ars medica, frutto di studio, di dedizione e di sacrificio, applicati nelle nostre corsie, con discrezione, senza platealità, secondo il classico “stile internistico”.
E questo è il momento di innamorarsi o di re-innamorarsi della Medicina Interna, perchè, come dice un nostro amico campano: “ ’A Medicina Interna è n’ata cosa, c’insegna ch’ è ’na persona ogni uomo, fatto a petali sì,… comme a ’na rosa, ma si se sfronna, po’,…. perde ’o profumo”.
Proprio nello studio degli squilibri idro-elettrolitici appare evidente il concetto che ogni singolo paziente è “unico, irripetibile, in divenire, indivisibile, in relazione con l’ambiente esterno ed interno, in cerca di equilibrio (chimico-fisico, psichico... e, non ultimo, spirituale)”.
L’Uomo, infatti, non può essere considerato solo un insieme di anioni e cationi, o di acidi e di basi, ma, in maniera eclatante e ineluttabilmente, è da sempre alla ricerca del significato della sua esistenza e delle sue origini
nell’Universo.
Lo stesso Henderson, lo scienziato cui dobbiamo essere tutti debitori, “preferiva studiare le variabili tra i sistemi, con l’attenzione volta a caratterizzare la loro struttura e la loro organizzazione, essendo dell’opinione che potrebbe essere possibile, con i mezzi matematici, descrivere le relazioni esistenti non solo tra gli organismi viventi, ma anche nella società e nell’universo in generale” (46)
Ricercare questi “meccanismi primordiali” e le “teorie unificanti” per capire gli equilibri omeostatici, rappresenta la visione “olistica” che è tipica del “metodo internistico”.
“Metodo e mentalità” che conducono il Medico ad
interrogarsi continuamente sul concetto della vita,
sulla sua origine e sulla sua migliore conservazione, perseguendo lo
scopo nobile della Medicina,
che abbiamo prescelto a 18 anni e che non si capisce perchè, poi, potrebbe o
dovrebbe essere rinnegato.
E questa continua ricerca del significato della nostra
esistenza, ci porta,
inevitabilmente ad “equilibri omeostatici superiori”, non solo chimici,
ed alla visione filosofica e religiosa del mistero e dell’ “Infinito”.
Ma l’Infinito non può essere contenuto nel Finito e,
quindi, ogni giorno,
non possiamo che prendere atto della nostra piccolezza, pur sapendo che
ogni Uomo può essere considerato una scintilla di Dio.
“E mi sovvien l’ Eterno......così tra questa immensità s’annega il pensier mio e il naufragar m’è dolce in questo mare” (G. Leopardi ,L’Infinito, 1819).
BIBLIOGRAFIA
1) Bernard C (1865) Introduction a l’étude de la Medicine expérimental. Ed JB Baillere et fils, Paris. (Ed. it. -1994 - Introduzione allo studio della medicina sperimentale. Piccin, Padova)
2) Henderson LJ. (1908) Concerning the Relations between the Strenght of Acids and their Capacity to Preserve Neutrality. Am J Physiol 21:173-179
3) Henderson LJ (1908) The Theory of Neutrality Regulation in the Animal Organism. Am J Phisiol 21: 427-448.
5) Loeb J (1916) The organism as a whole, from a physico-chemical viewpoint. G.B. Putnam’s Sons, New York, London
8) Cannon WB (1926) in Petitt A., Homage à Charles Richet. Presse Institut, Paris, 1926, p. 9.
9) Cannon WB (1932) The Wisdom of the body. Ed Norton, New York. Peter Smith, London, (ristampato 1979)
10) Guarini G e collab (1995) Fisiologia e fisiopatologia dei feed-back omeostatici. Stato dell'arte e prospettive. In: Atti XCVI Congr. Soc. Ital Med. Int., Ed Pozzi Roma, Vol. I, 355-431
11) Sorensen S.L. (1909) Enzymstudien. II. Uber die Messung und die Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen. Biochem. Z. Vol. 21:131, 201
13) Vulterini S.: Le basi fisiopatologiche dell’equilibrio acido-base. Il policlinico – Sezione pratica, 1994, Vol. 101, N.21, 720-752.
14) Rose D.B.: Fisiologia clinica dell’equilibrio acido-base e dei disordini elettrolitici. 1995, Mc Graw-Hill Libri Italia, Milano.
15) Sgambato F.: Un nuovo teorema. Ovverosia può la filosofia napoletana essere applicata all’equilibrio acido-base? Ah saperlo, saperlo. Eur. Resp. News, 1995, Anno III, N 2, 45-48.
16) Sgambato F., Prozzo S., Caporaso C.: L’equilibrio acido-base nella pratica clinica senza logaritmi, Atti del quinto seminario in «Equilibrio acido base ed idroelettrolitico», Incontri al Fatebenefratelli, 1998, 51-65, Benevento.
17) Sgambato F., Prozzo S.: L’equilibrio acido-base non è un tema ostico. Bullettino delle scienze mediche, 2003, Anno CLXXV, Fasc. 1, 35-50.
18) De Crescenzo L.: Panta rei (tutto scorre). 1994, Mondadori Editore, Milano.
19) Gamble J (1947) Chemical anatomy, Physiology and Pathology of extracellular fluid. Harvard Univers. Press, Cambridge
20) Passaro G (1999) Ionogramma. Enc Med Ital Vol. 7, 2461-2472
21) Sgambato F, Prozzo S (2003) Gap anionico: un ponte tra i due equilibri. Giorn Ital Med Int 2 (1), 20-27. (Free text: www.incontrifatebenefratelli.com nel settore “Pubblicazioni”)
23) Rose B. D (1991) Fisiologia clinica dell’equilibrio acido base e dei disordini elettrolitici, Mc Graw Hill Italia, Milano
24) Sgambato F (2005) Gli equilibri omeostatici in Medicina: le interrelazioni fra i sistemi. In: Atti 10° Congr Nazion FADOI in G I M I, 4, 1 (Suppl. 2), 13-23. (Free text: www.incontrifatebenefratelli.com nel settore “Pubblicazioni”)
26) Sgambato F., Prozzo S., 2003 - Le iponatremie: problemi diagnostici e terapeutici, semplici e complessi. Giorn Ital Med Int Vol 2, Supplemento 2, 8-37, Atti 8° Congr Naz FADOI, Marzo . (Free text: www.incontrifatebenefratelli.com nel settore “Pubblicazioni”)
27) Sgambato F, Prozzo S, Caporaso C, Milani L, Sgambato E, Piscitelli G L (2007) La fisiopatologia clinica delle ipersodiemie. Relaz XI Congr Nazion FADOI 2006, Ital Journ Med 2: 6-18 . (Free text: www.incontrifatebenefratelli.com nel settore “Pubblicazioni”)
28) Adroguè HJ, Madias NE 1997 Aiding fluid prescription for the dysnatremias. Intensive Care Med 23 (3), 309-316
29) Adrogué HJ, Madias NE (2000) Primary Care: Hyponatraemia. N Engl J Med, 342, 1581-1589, 2000.
30) Humes HD, Narins RG, Brenner BM (1981) Alterazioni del bilancio idrico. Hospital Practice March ’79, Minuti Menarini 27, 19-31
31) Bartoli E (1976) Fisiopatologia e clinica degli squilibri idro-elettrolitici. La Medicina Internazionale, 23, 1-108
35) Arieff AI, Ayus JC, Martin AJ, Bruns DE, Ladenson JH, Scott MG, Kashyap AS, Kashyap S, van Heyningen C, Gill GV, Watson ID, Berl T, Adrogué HJ, Madias NE (2000) Hyponatraemia. N Engl Med 343, 886-888
36) Kumar S, Berl T (1998) Electrolyte quintet: Sodium. Lancet; 352, 9123
39) Sterns RH (1990) The treatment of hyponatremia: First, do no harm. Am J Med 88:557
41) Rose B D (2003) Treatment of hyponatremia. UpToDate www.utdol.com/application
42) Reynolds R M, Padfield P L, Seckl J R (2006) Disorders of sodium balance. Clinical review. B M J 332:702-705
43) Martin G S (2005) An Update on Intravenous Fluids. Highlights 25th Intern Sympos Int Care Emer Med – Medscape http://www.medscape.com/viewarticle/503138
45) Sgambato F., Prozzo S., Sgambato E., Milano L., Piscitelli G. L., Fucci A. – L’equilibrio idro-elettrolitico in Medicina Interna: guida ad una terapia infusionale ragionata. Relazione 10* Congr. Naz. S.I.M.I., Intern Emerg Med, 2008, 3: S236 – S252
46) Astrup P., Severinghaus J. W. – The history of blood gases, acids and bases., 1986, Radiometer A/S, Copenhagen.
RIASSUNTO : Lo studio degli equilibri omeostatici è un cardine nell’armamentario culturale di ogni Medico.
Ciononostante, raramente viene effettuato un approccio sistematico a questi temi, che trovano spazio solo marginalmente nei vari Congressi, mentre l’Acqua, il Sodio, il Potassio, gli Idrogenioni, i Bicarbonati, la volemia, la osmolalità, etc.. sono “essenziali per il mantenimento della vita”.
I Pazienti internistici critici, pluripatologici e complessi sono meritevoli di una cultura attenta a queste problematiche “sistemiche”, che rappresentano il nocciolo della visione olistica e della mentalità tipicamente internistica.
La chiave del problema è ritrovare “l’insieme armonioso” dei vari elettroliti ed il nostro lavoro approfondisce tali argomenti, curando gli aspetti fisio-patologici e terapeutici pratici.
Parole-chiavi: Equilibrio idro-elettrolitico, Equilibrio acido-base, Equilibrio osmolare, Equilibrio volemico
SUMMARY : The study of omeostatic balance is pivotal in the "cultural arsenal" of every Doctor.
Nevertheless, a systematic approach to these issues is rarely carried out and they are only marginally discussed in the various congress; yet water, sodium, potassium, idrogenions, bicarbonates, osmolality, volemic balance, etc… are "crucial to preserve life".
Critical multipathological and complex internistic patients deserve a careful knowledge which pays attention to these "systemic" issues, that represent the core of holistic vision and of the typical internistic mentality.
The solution to this problem is finding again "the harmony" of electrolytes and this paper goes into all these topics investigating practical physiopathological and therapeutic aspects.
KEY WORD: Idro-electrolitic balance, Acid-base balance, Osmolar balance, Volemic
Balance.