ANEMIA E SINDROME CARDIO – RENALE
L. Di Lullo
INTRODUZIONE
E’ esperienza comune, in ambito nefrologico, riscontrare come pazienti ricoverati nei reparti di nefrologia presentino sovente un quadro di anemia secondaria a malattia renale cronica (CKD) accompagnato a sintomi clinici compatibili con la presenza di scompenso cardiaco congestizio (CHF).
La triade composta da anemia, CKD e CHF è stata definita come sindrome cardio – renale da anemia secondaria e si va ad inquadrare, come da classificazione quasi universalmente riconosciuta, nell’ambito della sindrome cardio – renale di tipo IV, quella definita come reno – cardiaca cronica
Le tre componenti sopra descritte vanno, alla resa dei conti, a costituire una sorta di circolo vizioso nel quale ciascuna condizione clinica può diventare causa e/o effetto dell’altra.
L’anemia, infatti, può peggiorare la condizione di CHF preesistente e si associa con un aumento sia del tasso di ospedalizzazione che di mortalità; dall’altro lato, una condizione di anemia non adeguatamente corretta, si associa anche ad una pessima prognosi per quanto concerne la funzionalità renale.
La presenza di scompenso cardiaco congestizio si associa ad outcomes di funzione renale sicuramente più sfavorevoli, così come la progressione della CKD determina un peggioramento del quadro ematologico provocando un ulteriore aggravamento del quadro cardiologico.
EPIDEMIOLOGIA
Circa l’80% dei pazienti ricoverati in degenza nefrologica ed affetti da malattia renale cronica con anemia secondaria presenta un interessamento cardiaco (2 – 5); inoltre, circa il 50% di questi pazienti presenta un quadro di dislipidemia, di ipertensione arteriosa e di diabete mellito (1 - 4).
Da uno studio USA effettuato da Medicare è stato evidenziato come l’associazione di anemia, CHF e CKD aumentano del 50 – 100% il rischio di morte nei pazienti affetti da CKD stadio V (5)
In un altro studio condotto su 142 pazienti affetti da CHF, 58 (pari a circa il 41%) presentavano valori di filtrato glomerulare inferiori a 40 ml/min/1.73 m2 (3); l’associazione tra grado di coinvolgimento renale e classe NYHA è stato confermato da diversi autori (6, 7) e la presenza di malattia renale cronica è stata identificata come un fattore indipendente di mortalità nei pazienti affetti da CHF (6,7).
Lo stato uremico contribuisce ai processi di fibrosi miocardica ed alla riduzione della densità capillare a livello dei miocardiociti (8) da un lato, mentre, sul versante renale, determina un’accelerazione del danno aterosclerotico con evidenti conseguenze sui processi di ultrafiltrazione glomerulare (8).
Nei pazienti affetti da CHF è molto frequente la presenza di uno stato anemico anche se, in diversi trials clinici, la percentuale risulta estremamente variabile oscillando dal 10 al 25% in alcuni di essi (9, 10) e dal 40 al 60% in altri (11, 12).
Tale differenza può, in parte, anche essere dovuta a ciò che i diversi autori intendono per anemia ma, attualmente, le linee guida KDOQI indicano come target emoglobinico ideale quello rappresentato da livelli di Hb compresi tra 11.5 e 12.5 g/dl.
Nello studio di Silveberg (13) condotto su 142 pazienti affetti da CHF, il riscontro di anemia, intesa come livello di Hb sierica < 12 g/dl, era decisamente più frequente nei pazienti in classe NYHA IV (79% dei pazienti con valori medi di Hb pari a 10.9 g/dl) rispetto ai pazienti in classe NYHA I (solo il 9.1% dei pazienti presentava livelli di Hb < a 12 g/dl)
FISIOPATOLOGIA
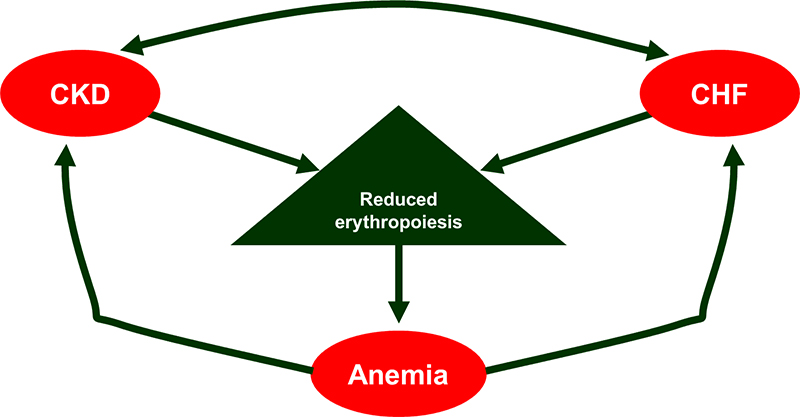
Nella figura 1 sono schematizzati gli stretti rapporti tra anemia, scompenso cardiaco congestizio (CHF) e malattia renale cronica (CKD).
Dalla figura si evince chiaramente come una condizione di scompenso cardiaco sia in grado di determinare malattia renale cronica ed anemia secondaria; allo stesso tempo anche la progressione della malattia renale cronica è in grado di condizionare l’insorgere e/o il peggiorare di un quadro di insufficienza cardiaca grazie alla presenza di uno stato di anemia secondaria, così come la stessa presenza di un quadro anemico condiziona sia la progressione della CKD, sia l’evoluzione della patologia cardiaca.

Fig. 1 Il “circolo vizioso” della Cardio – renal anemia syndrome”
Legenda CKD: chronic kidney disease, CHF: chronic heart failure
Sono diversi i meccanismi attraverso i quali una condizione di anemia può contribuire all’instaurarsi ovvero al peggioramento di una condizione di scompenso cardiaco.
In primo luogo, la carenza di ossigeno correlata alla diminuzione dei livelli circolanti di emoglobina determina un aumento del lavoro cardiaco con conseguente aumento della frequenza cardiaca e del cosiddetto “stroke volume”; nel caso in cui non venisse apportata alcuna correzione al quadro ematologico, l’evoluzione più frequente è verso il danno di natura ipossica – ischemica fino ad un evento infartuale potenzialmente fatale (13).
La presenza di anemia, inoltre, condiziona un grado variabile di ischemia tissutale con susseguente vasodilatazione e diminuzione della pressione arteriosa sistemica (14); ciò determina un’attivazione del sistema nervoso simpatico la quale, oltre a determinare tachicardia ed aumento della volemia, determina vasocostrizione a livello renale e successiva ritenzione idrosalina (15).
La riduzione del flusso plasmatico renale attiva, a sua volta, il sistema renina – angiotensina – aldosterone (RAAS) con ulteriore successiva vasocostrizione renale. Il risultato finale, legato anche alla ritenzione idrosalina, è quello di produrre imponenti edemi periferici ed aumento del volume plasmatico.
L’aumento della volemia provoca la dilatazione delle sezioni cardiache di sinistra e, più in particolare, del ventricolo sinistro con lo sviluppo di un importante quadro di ipertrofia ventricolare sinistra, evento temibile e piuttosto frequente nei pazient affetti da malattia renale cronica (16).
Volendo vedere l’aspetto fisiopatologico da un altro punto di vista, possiamo affermare che la condizione di scompenso cardiaco congestizio predispone e si accompagna ad una condizione di anemia, anche indipendentemente dalla presenza di danno renale.
Studi sperimentali hanno evidenziato come, in caso di insufficienza cardiaca, il cuore sia in grado di produrre citochine, come il tumor necrosis factor alfa (TNF-α), in grado di causare anemia riducendo la produzione di eritropoietina (EPO) a livello renale ovvero interferendo con l’attività della stessa EPO a livello midollare ed, infine, inibendo il rilascio di ferro da parte delle cellule del sistema reticolo – endoteliale in modo tale che il ferro non possa essere reso disponibile per la sintesi di emoglobina (17)
I pazienti affetti da scompenso cardiaco cronico, inoltre, presentano spesso dei quadri piuttosti evidenti di malnutrizione con aumento degli indici di flogosi cronica (proteina C- reattiva, PCR, interleuchina 6 ed interleuchina 12); la presenza di una condizione infiammatoria cronica determina una resistenza, da parte delle cellule bersaglio, all’azione dell’EPO (18)
Nei pazienti affetti da CHF, infine, la presenza di anemia può essere legata ad una condizione di emodiluizione, soprattutto in quei pazienti nei quali la terapia diuretica ancora non ha ottenuto i benefici auspicati (19) e che sono candidati a trattamenti di emodialisi - ultrafiltrazione
TERAPIA
La figura 2 illustra schematicamente l’algoritmo riguardante il trattamento dell’anemia secondaria a CKD.

Fig. 2 Algoritmo terapeutico del trattamento dell’anemia secondaria in corso di CKD
L’avvento dell’eritropoietina ricombinante si è rivelato di importanza cruciale per il trattamento dell’anemia nei pazienti affetti da CKD, in precedenza sottoposti esclusivamente a terapia marziale e, nei casi più gravi, ad emotrasfusione.
Allo stato attuale, in commercio, vi sono l’eritropoietina alfa (EPO-α) e l’eritropoietina beta (EPO-β) quali ESA con durata d’azione rapida e somministrati, generalmente, due – tre volte a settimana (per via sottocutanea ovvero endovenosa).
Seguendo un criterio di ordine cronologico, sono state successivamente immesse in commercio la Darbopoetina alfa ed il C.E.R.A., molecole modificate rispetto alle eritropoietine originali in grado di garantire emivite ed effetti farmacologici più duraturi con risparmio sia in senso economico, sia in termini di numero di somministrazioni per il paziente.
In accordo con le linee guida internazionali, tutti i pazienti affetti da CKD vanno trattati nel momento in cui il loro livello di emoglobina sierica scende al di sotto di 11 g/dl (20).
Prima di iniziare una terapia con ESA è bene escludere tutte quelle cause di anemia non correlate ad un deficit di produzione di eritropoietina.
Se coesiste un livello di ferritina inferiore a 100 μg/L ovvero vi è una condizione di ridotta risposta alla somministrazione di ferro, si impone l’inizio del trattamento con ESA; la dose iniziale di eritropoietina è solitamente quella di 50UI/kg in due/tre somministrazioni settimanali. Con tale dose d’attacco, in genere, si assiste ad un aumento della quota reticolocitaria entro 3 – 4 giorni dalla somministrazione e ad un aumento dei livelli di emoglobina (da 0.25 a 0.5 g/dl a settimana) entro 1 – 2 settimane.
Nel caso in cui il paziente non rispondesse a tale dose iniziale, quest’ultima può essere aumentata in un range variabile tra il 25 ed il 50% onde raggiungere il target raccomandato di 11 – 13 g/dl.
Per parlare di resistenza alla terapia con ESA si deve assistere alla persistenza di valori di Hb inferiori a 11 g/dl, nonostante il crescente aumento delle dosi di EPO somministrata. Le cause principali di iporesponsività al trattamento con ESA risiedono nella presenza di un deficit di ferro ovvero nella persistenza di una condizione di infiammazione cronica e, in coloro i quali sono sottoposti a trattamento sostitutivo della funzione renale, di inadeguata dose dialitica (21).
BIBLIOGRAFIA
1. Silverberg DS, Wexler D, Blum M et al.The correction of anemia in severe resistant heart failure with erythropoietin and intravenous iron prevents the progression of both the heart and renal failure and markedly reduces hospitalization.Clin Nephrol 2002; 58 [Suppl 1]: S37–S45
2. Silverberg DS, Wexler D, Blum M et al The effect of correction of anemia in diabetic and non diabetics with severe resistant congestive heart failure and chronic renal failure by subcutanous erythropoietin and intravenous iron.Nephrol DialTransplant2003; 18: 141–146
3. Silverberg DS, Wexler D, Blum M et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function, functional cardiac class, and markedly reduces hospitalizations. J Am Coll Cardiol 2000; 35: 1737–1744
4. Silverberg DS, Wexler D, Sheps D et al.The effect of correction of mild anemia in severe resistant heart failure using subcutaneous erythropoietin and intravenous iron: randomized controlled study. J Am Coll Cardiol 2001; 37: 1775–178
5. Gilbertson D, Li S, Murray AM, Herzog CA, Collins AJ.Competing risks of death vs ESRD in Medicare beneficiaries age 65 with chronic kidney disease CHF and anemia. J Am Soc Nephrol 2002; 13: SA84
6. Hillege HL, Girbes ARJ, De Kam PJ et al. Renal function, neurohormonal activation and survival in patients with chronic heart failure. Circulation 2000; 102: 203–210
7. Dries DL, Exner DV, Domanski MJ, Greenberg B, Stevenson LW. The prognostic implications of renal insufficiency in asymptomatic and symptomatic patients with left ventricular systolic dysfunction. J Am Coll Cardiol 2000; 35: 681–689
8. Amann K, Tyralla K. Cardiovascular changes in chronic renal failure.Clin Nephrol 2002; 58 [Suppl 1]: S62–S72
9. Siverberg DS, Wexler D, Blum M, Iaina A. The cardio renal anemia syndrome: correcting anemia in patients with resistant congestive heart failure can improve both cardiac and renal function and reduce hospitalizations.Clin Nephrol 2003; 60: S93–S102
10. Cromie N, Lee C, Struthers AD. Anaemia in chronic heart failure: what is the frequency in the UK and its underlying cause? Heart 2002; 87: 377–378
11. Wisniacki N, Aimson P, Lyle M. Is anemia a cause of heart failure in the elderly? Heart 2001; 85 [Suppl 1]: P4
12. Kosiborod M, Smith GL, Radford MJ, Foody JM, Krumholz HM. The prognostic importance of anemia in patients with heart failure. Am J Med 2003; 114: 112–119
13. Silverberg D, Wexler D, Blum M, Wollman Y, Iaina A. The cardio-renal anaemia syndrome: does it exist? Nephrol Dial Transplant. 2003 Nov;18 Suppl 8:viii7-12.
14. Anand IS, Chandrashekhar Y, Ferrari R, Poole-Wilson PA, Harris PC. Pathogenesis of oedema in chronic anaemia: studies of body water and sodium, renal function, haemodynamics and plasma hormones. Br Heart J 1993; 70: 357–362
15. Johnson DB, Dell’Italia LJ. Cardiac hypertrophy and failure in hypertension. Curr Opin Nephrol Hypertens 1996; 5: 186–191
16. Katz AM. The cardiomyopathy of overload: an unnatural growth response in the hypertrophied heart. Ann Intern Med 1994; 121: 363–371
17. Means RT. Advances in the anemia of chronic disease. Int J Hematol 1999; 70: 7–12
18. Horwich TB, Fonarow GC, Hamilton MA, MacLellan WR, Borenstein J. Anemia is associated with worse symptoms, greater impairment in functional capacity and a significant increase in mortality in patients with advanced heart failure. J Am Coll Cardiol 2002; 39: 1780–1786
19. Androne A-S, Katz SD, Lund L et al. Hemodilution is common in patients with advanced heart failure. Circulation 2003; 107: 226–229
20. KDOQI anemia guidelines in CKD patients. Am J Kidney Dis 2006; 47 (Suppl 3):S1 – S146
21. Macdougall IC, Cooper AC. Hyporesponsiveness to erythropoietic therapy due to chronic inflammation. Eur J Clin Invest 2005;35 (Suppl 3): 32 – 35
Luca Di Lullo
U.O.C. Nefrologia e Dialisi Ospedale L. Parodi–Delfino Colleferro (Roma)