La pandemia del diabete: perché e come affrontarla
P. Pozzilli, R. Strollo
Il diabete di tipo 2 è una malattia cronica in rapido aumento a livello mondiale. Le stime attuali prevedono che nel 2030 ci saranno 360 milioni di diabetici rispetto ai 170 milioni registrati nel 2000 (1), con il maggiore tasso d’incremento nei paesi in via di sviluppo, come Asia e Africa. Tale malattia e le complicanze che ne derivano rappresentano pertanto un importante problema di salute pubblica che incide notevolmente sui costi sanitari (1).
Il diabete di tipo 2 rappresenta un continuum fisiopatologico preceduto da una stato metabolico noto come prediabete. Tale condizione è caratterizzata da un aumentato rischio di sviluppare diabete ed è spesso associata a ulteriori alterazioni fisiopatologiche e metaboliche, quali obesità, ipertensione, dislipidemia e precoci alterazioni vascolari (2-5). Attualmente, oltre un terzo della popolazione mondiale è affetta da prediabete (6). Numerosi trial clinici hanno mostrato la possibilità di prevenire e ritardare la comparsa di diabete intervenendo proprio a questo livello nella storia naturale della malattia (7).
Le modifiche dello stile di vita nella prevenzione del diabete
Due importanti fattori di rischio per il diabete di tipo 2 sono l’incremento ponderale e la sedentarietà (8). L’obesità può aggravare l’insulino-resistenza e la disfunzione beta-cellulare attraverso l’alterata produzione di adipochine, l’anomala deposizione di grasso e la disfunzione mitocondriale (8,9). Numerosi trials hanno stabilito che le modifiche dello stile di vita, come calo ponderale ed esercizio fisico moderato, riducono il rischio di diabete di tipo 2 (Tabella 1).
Tabella 1 – Modifiche dello stile di vita nella prevenzione del diabete di tipo 2
|
Trial |
N |
Popolazione |
Follow-up (anni) |
Intervento |
RR (95% IC) |
|
Da Qing |
577 |
IGT (Cina) |
6 |
1. Dieta 2. Esercizio 3. Dieta & Esercizio |
0.66 (0.53-0.81) 0.56 (0.44-0.70) 0.49 (0.33-0.73) |
|
DPS |
522 |
IGT sovrappeso (Finlandia) |
3.2 |
Dieta & Esercizio |
0.42 (0.3-0.7) |
|
DPP |
3234 |
IGT (USA) |
2 |
1. Dieta & Esercizio 2. Metformina |
0.42 (0.34-0.52) 0.69 (0.57-0.83) |
|
IDPP |
531 |
IGT (India) |
2.5 |
1. Dieta & Esercizio 2. Metformina 3. Metformina + Dieta & Esercizio |
0.72 (0.62-0.80) 0.74 (0.65-0.81) 0.72 (0.62-0.80) |
DPS, Finnish Diabetes Prevention Study; DPP, Diabetes Prevention Program; IDPP, Indian Diabetes Prevention
Program; RR, rischio relativo, IC, intervallo di confidenza
Nel Diabetes Prevention Program (DPP), soggetti prediabetici con BMI superiore a 24 Kg/m2, sottoposti a dieta e regolare attività fisica, presentavano una riduzione del rischio di sviluppare diabete pari al 58% rispetto al gruppo di controllo (10). I soggetti appartenenti al gruppo d’intervento svolgevano un’attività fisica di modesta intensità per oltre 150 minuti settimanali, ottenendo un calo ponderale di oltre il 7% del peso corporeo.
Nel Finnish Diabetes Prevention Sudy (DPS), soggetti con alterata tolleranza al glucoso (Impaired Glucose Tolerance, IGT) e sovrappeso svolgevano attività fisica per più di 30 minuti al giorno, perdendo più del 5% del loro peso, grazie al minor introito di grassi saturi nella dieta e al maggior apporto di fibre (11). L’incidenza cumulativa del diabete, lungo un periodo di osservazione di 3.2 anni, era del 58% in meno nel gruppo di intervento rispetto al gruppo di controllo.
Nel China Da Qing Diabetes Prevention Study (CDQDPS), veniva confrontata l’efficacia dell’intervento singolo vs. combinato con dieta e/o attività fisica in 577 individui cinesi con IGT (12). Nei 6 anni di osservazione, l’incidenza del diabete di tipo 2 era minore nei tre gruppi di intervento (solo dieta 48%, solo attività fisica 41%, dieta ed esercizio 46%) rispetto al gruppo di controllo.
Tutti e tre i trial hanno dimostrato gli effetti benefici delle modifiche dello stile di vita sulla prevenzione del diabete. Inoltre, un follow-up post-intervento nei 10 anni successivi al DPP mostrava che l’effetto dello stile di vita è duraturo; il gruppo precedentemente trattato mostrava un tasso di incidenza di diabete inferiore del 34 % rispetto al gruppo non trattato, nonostante la ripresa di circa 5 Kg di peso (13). Allo stesso modo, nel follow-up post-trial a 7 anni del DPS, l’intervento sullo stile di vita conservava una riduzione del rischio cumulativo di diabete pari al 15% (14). Nello studio CDQDPS l’effetto sulla prevenzione rimaneva costante per circa 14 anni dall’intervento attivo (15).
Prevenzione farmacologica del diabete
Vari trials clinici hanno suggerito che il trattamento farmacologico può essere efficace nel prevenire lo sviluppo del diabete (Tabella 2). Tuttavia, nella pratica clinica la prevenzione farmacologica del diabete è ancora limitata dalla mancanza di evidenze mostranti un effetto preventivo duraturo nel tempo, nonché dalla presenza di effetti collaterali e dai maggiori costi.
Tabella 2 – Principali trials di prevenzione farmacologica del diabete di tipo 2.
|
Trial |
N |
Popolazione |
Farmaco |
Follow-up (anni) |
RR (95% IC) |
Peso |
Eventi avversi |
|
DPP |
3234 |
IGR Sovrappeso |
Metformina (850mg bid) |
2.8 |
0.69 (0.57-0.83) |
↓ |
Sintomi GI |
|
STOP-NIDDM |
1419 |
IGT |
Acarbosio (100mg tid) |
3.9 |
0.75 (0.63-0.90) |
|
Sintomi GI |
|
Voglibose |
1780 |
IGT |
Voglibosio (0.2mg tid) |
3 |
0.59 (0.43-0.81) |
|
Sintomi GI |
|
DREAM |
5269 |
IGR |
Rosiglitazone (8mg/day) |
3 |
0.40 (0.35-0.46) |
↑ |
Edema |
|
ACT-NOW |
602 |
IGT |
Pioglitazone (30-45mg/day) |
2.4 |
0.28 (0.16-0.49) |
↑ |
Edema, Dislipidemia |
|
XENDOS |
3277 |
IGT obesi |
Orlistat (120mg tid) |
4 |
0.72 (0.58-0.91) |
↓ |
Sintomi GI |
|
ORIGIN |
1456 |
IGR |
Glargine |
6 |
0.80* (0.64-1.00) |
↑ |
Ipoglicemia |
* Odds Ratio; IGR, Impaired glucose regulation; GI, Gastro-intestinale; RR, rischio relativo, IC, intervallo di confidenza
Metformina La metformina è l’unico farmaco approvato dall’American Diabetes Association nella prevenzione del diabete di tipo 2. Sebbene si sia mostrata meno efficace dello stile di vita, il DPP ha dimostrato che il trattamento con tale farmaco al dosaggio di 850 mg due volte al giorno in soggetti prediabetici riduceva l’incidenza di diabete del 31% rispetto al gruppo di controllo (10). Nell’Indian Diabetes Prevention Program (IDPP), condotto su 531 soggetti indiani con IGT, dosi più basse di metformna (500mg/die) riducevano il rischio di diabete del 26.4% (16). Al contrario, non emergeva nessun sinergismo dalla combinazione di metformina e modifiche dello stile di vita (16). Inoltre, l’effetto protettivo della metformina persisteva in parte anche dopo sospensione del farmaco (17).
Inibitori dell’alfa-glucosidasi Il trial STOP-NIDDM su 1419 pazienti con IGT ha dimostrato che il gruppo trattato con acarbosio presentava una riduzione del rischio di diabete del 25%, rispetto al gruppo placebo durante un follow-up di circa 3.3 anni (18). Inoltre, l’acarbosio riduceva del 34% il rischio di nuovi casi d’ipertensione, e del 49% quello di eventi cardiovascolari (19). In modo simile, il voglibosio riduceva del 40.5% lo sviluppo del diabete di tipo 2 rispetto al placebo (20). Nonostante tale efficacia, l’uso di tali farmaci nella prevenzione del diabete è ancora dibattuto a causa del costo e degli effetti collaterali gastrointestinali (diarrea e flatulenza).
Tiazolidinedioni I tiazolidinedioni riducono l’insulino-resitenza agendo come agonisti del PPAR-gamma. Nello studio DREAM il trattamento con rosiglitazone (8mg/die) per tre anni riduceva l’incidenza di diabete tipo 2 del 62% (21); tuttavia, tale effetto veniva perso alla sospensione del farmaco. Inoltre, il possibile aumento del rischio d’infarto e mortalità nei soggetti trattati con rosiglitazone (22, 23) ne ha disposto il ritiro dal commercio europeo e ne ha limitato notevolmente l’utilizzo negli USA. Nello studio ACT-NOW condotto su circa 600 pazienti con IGT, il pioglitazone (30-45 mg/die) riduceva l’incidenza di diabete ma era associato ad incremento ponderale e comparsa di edema (24).
Insulina Lo studio ORIGIN condotto su oltre 12000 pazienti ha esaminato in un gruppo di soggetti con prediabete l’effetto dell’insulina Glargine sullo sviluppo di diabete. I soggetti trattati con insulina basale presentavano una riduzione relativa del rischio pari al 20% circa. Tuttavia si registravano maggiori eventi ipoglicemici e incremento ponderale nel gruppo d’intervento rispetto al gruppo di controllo (25).
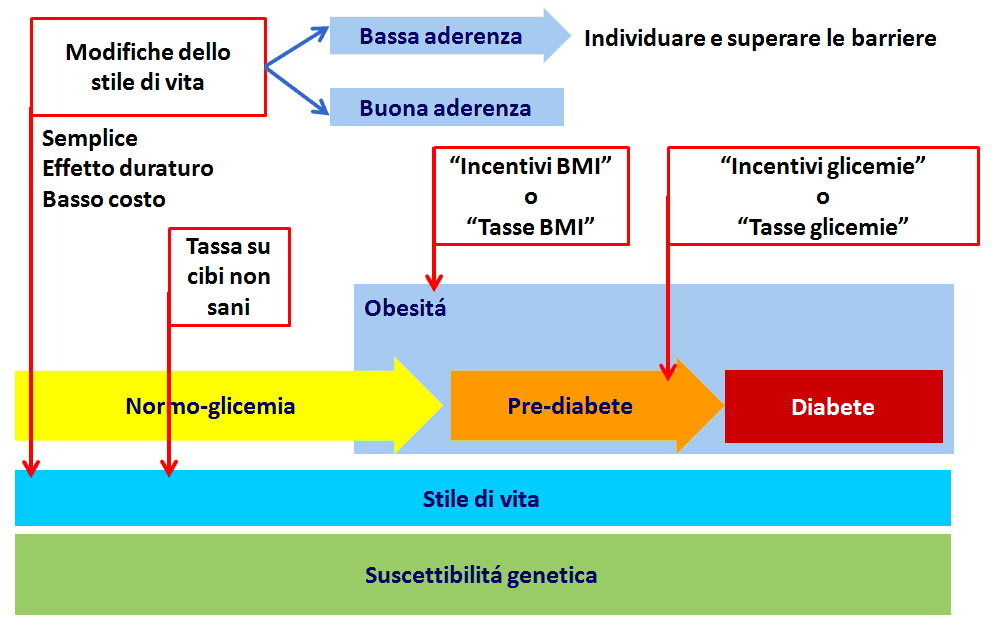
Come fermare la pandemia?
Nonostante l’accumulo di evidenze scientifiche sulla possibilità di prevenire o ritardare l’insorgenza del diabete tipo 2, la frequenza di tale patologia e dei disturbi ad essa associati, come l’obesità, continua ad aumentare notevolmente in tutto il mondo. Ciò può sorprendere se si considera che interventi relativamente semplici, efficaci e poco costosi come le modifiche dello stile di vita hanno mostrato aderenza piuttosto elevata durante i trial clinici condotti (10-12). Tuttavia, la realtà clinica può essere piuttosto differente. A tal proposito, i dati del Food and Agriculture Organization of the United Nations mostrano come l’introito calorico pro capite sia aumentato di quasi il 30% dal 1970 ad oggi e che tale aumento è ascrivibile principalmente a cibi ad alto contenuto di grassi (26). Contemporaneamente, il costo dei cibi ricchi in cardoidrati e grassi si è ridotto del 30-50% mentre quello di cibi cosiddetti sani come frutta e verdure è rimasto simile o addirittura aumentato, condizione che ha verosimilmente favorito la promozione di una dieta non corretta. Per fronteggiare l’epidemia del diabete, varie strategie preventive sono state attuate anche a livello politico/nazionale. Ad esempio, a partire dagli anni ’80 vari governi hanno introdotto tassazioni su cibi reputati poco sani, come bevande zuccherate o cibi ricchi in grassi saturi, con lo scopo di favorire il consumo di una dieta maggiormente salutare da parte della popolazione (27). È interessante notare che le evidenze scientifiche, sebbene scarse, hanno effettivamente mostrato che la tassazione di cibi ad alto contenuto calorico come le bevande zuccherate o la pizza può ridurre l’introito calorico individuale derivante da tali cibi (28). Uno studio longitudinale su 5115 giovani adulti studiati dal 1985 al 2006 ha mostrato che una tassazione del 10% delle bevande gasate o della pizza riduceva del 7 % e 10%, rispettivamente, l’introito calorico derivante da tali cibi; ciò si associava ad una riduzione del peso corporeo e dei livelli di inulina nell’arco dei 20 anni successivi alla’introduzione della tassazione (28). Tuttavia, ulteriori evidenze sono necessarie per poter chiarire il ruolo di tali strategie politiche sulla prevenzione dell’obesità e del diabete tipo 2.
Un approccio interessante, inoltre, è l’utilizzo di incentivi economici per la perdita di peso e il controllo glicemico. Tale strategia è in studio da oltre trenta’anni (29) e un recente trial ha ottenuto buoni risultati (30); 57 soggetti adulti obesi venivano randomizzati in tre gruppi: 1) incentivi economici sottoforma di lotterie quotidiane in cui le vincite (relativamente frequenti) erano subordinate all’ottenimento del calo ponderale; 2) contratti che prevedevano depositi monetari effettuati dai pazienti e riottenuti alla fine dello studio, con eventuali interessi, solo nel caso dell’ottenimento del calo ponderale; 3) gruppo di controllo. A sedici settimane dall’inizio dello studio, i pazienti motivati economicamente presentavano peso corporeo significativamente piú basso dei soggetti nel gruppo di controllo, sebbene tale differenza tendeva a ridursi nelle settimane successive al termine dello studio (30). Un ulteriore lavoro su 105 soggetti con simili caratteristiche mostrava, inoltre, che l’efficacia degli incentivi economici era maggiore se applicata a piccoli gruppi di pazienti piuttosto che su base individuale (31). Uno studio simile è stato condotto in pazienti diabetici, ai quali venivano proposti incentivi economici (100-200$) per ridurre i livelli di HbA1c di almeno un punto percentuale (gruppo 1), oppure venivano assegnati a “tutor” personali, anch’essi diabetici, ma in buon compenso glicemico, che si impegnavano a contattare settimanalmente i soggetti studiati in cambio di compensi economici di circa 20$/settimana (gruppo 2). Alla fine dello studio, i soggetti in quest’ultimo gruppo presentavano un compenso glicemico significativamente migliore del primo gruppo e dei controlli non incentivati economicamente (32).
Sebbene sia difficile prevedere l’efficacia a lungo termine e l’appicabilitá di tali strategie su larga scala, la valutazione di un intervento politico che preveda incentivi economici o, al contrario, tassazioni aggiuntive per soggetti obesi o prediabetici potrebbe essere un ulteriore step da considerare nella formulazione di un piano di prevenzione efficace contro obesità e diabete di tipo 2 (figura 1).

Figura 1 – Una possibile strategia per affrontare l’epidemia del diabete di tipo 2
Riferimenti bibliografici
Paolo Pozzilli, Rocky Strollo
Unità operativa complessa di Endocrinologia & Diabetologia,
Università Campus Bio-Medico di Roma