LA BARRIERA INTESTINALE: nuove acquisizioni e approcci terapeutici
F. Scaldaferri, L. Lopetuso, S. Pecere, V. Gerardi, F.
Forte, A. Tortora, G. Ianiro, A. Gasbarrini
La barriera intestinale è definita come unità funzionale che pone i costante equilibrio l’imponente carica antigenica del lume intestinale con la complessa organizzazione immunologica e non immunologica della mucosa intestinale. Essa svolge due funzioni fondamentali per la sopravvivenza dell’individuo:
1. permettere l’assorbimento delle sostanze nutritizie;
2. difendere l’organismo dalla penetrazione di macromolecole dannose.
La complessità della barriera intestinale ne rende difficoltoso lo studio, ma negli ultimi anni la letteratura scientifica sta fornendo notevoli interessanti acquisizioni sulla fisiologia e la fisiopatologia di questo importante componente del nostro organismo.
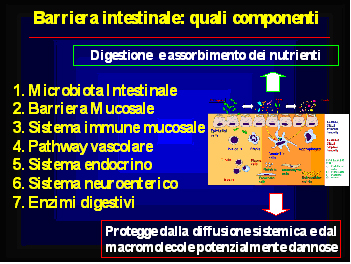
Come è noto, un elemento essenziale per il corretto funzionamento della barriera intestinale è rappresentata dalla flora intestinale (oggi meglio nota come “microbiota intestinale”) ma altrettanto importanti sono altri fattori, tra cui il layer mucoso, l’epitelio intestinale, i componenti della immunità naturale ed acquisita, il sistema endocrino e neuroenterico, il sistema vascolare-linfatico e gli enzimi digestivi (fig. 1)

Tutti questi componenti hanno tra loro delle complesse interrelazioni che permettono, in condizioni fisiologiche, di mantenere integra la capacità della barriera intestinale di impedire il passaggio a livello sistemico di sostanze dannose.
Per quanto riguarda il microbiota intestinale, è formata da una ricca popolazione microbica, comprendente batteri, miceti, batteriofagi e virus; questi microorganismi, in passato noti come “commensali” e modernamente definiti “mutualisti”, nel loro insieme consentono un adeguato controllo dell’apparato digerente; va ricordato che la concentrazione microbica e la composizione quali-quantitativa della flora varia nei diversi tratti dell’intestino.
Di recente è stato evidenziato che i batteri che ne fanno parte sono per il 70-90% degli anaerobi obbligati (Gram positivi, come Clostridium e Bifidobacterium, e Gram negativi, come Bacteroides); essi vengono anche detti “estremofili”, in quanto è estremamente difficoltoso coltivarli e per la loro crescita in coltura necessitano di tecniche microbiologiche sofisticate. Secondo quanto recentemente riportato da uno studio dell’Human Microbiome Project and European MetaHIT consortium, la flora batterica intestinale umana, pur essendo costituita da un grandissimo numero di ceppi diversi (si calcola circa 15000), può essere distinta in 3 grandi generi, ossia Bacteroides, Prevotella e Ruminococcus. A seconda del tipo di alimentazione dell’individuo, ciascuno di tali generi può risultare prevalente, dando origine a corrispondenti “enterotipi” diversi: ad esempio, i vegetariani “puri” hanno un “enterotipo” Ruminococcus mentre coloro che seguono la tipica dieta occidentale sono dell’enterotipo Bacteroides. Ciò può essere importante anche dal punto di vista metabolico, in quanto i diversi enterotipi hanno funzioni metaboliche differenti, a causa della prevalenza di determinati ceppi batterici rispetto ad altri. L’enterotipo tende a rimanere stabile in ciascun singolo individuo, e può essere ripristinato nella sua composizione anche dopo una sua momentanea alterazione, indotta ad esempio da terapia antibiotica. Il microbiota intestinale ha molte importanti funzioni per il mantenimento dello stato di salute dell’ospite:
- funzione di barriera
- immunostimolazione e immunotolleranza
- sintesi di sostanze
- funzione metabolico-trofica
- metabolismo dei farmaci e delle tossine
- condizionamento del comportamento.
Se la funzione di barriera è costante nelle varie zone dell’intestino, le altre sono parzialmente specifiche per diversi tratti intestinali. La funzione di immunostimolazione/immunotolleranza, ad esempio, è prevalentemente svolta a livello dell’intestino tenue, mentre quella metabolico-trofica è prevalente a livello dell’intestino crasso.
Va sottolineato che la composizione del microbiota intestinale nella prima età infantile è di importanza cruciale per la cosiddetta “educazione immunologica” dell’individuo: difatti, una carente esposizione dei bambini piccoli ai Bifidobacterium e/o l’eliminazione dei bifidobatteri dall’intestino (conseguente ad antibioticoterapia) può determinare una maturazione “sbilanciata” del sistema immunitario (con una carente “rimozione” della risposta Th2, tipica del neonato).
Questo fenomeno, che è stato definito “Freudianesimo immunologico”, è in aumento nei Paesi occidentali a causa di svariati fattori (prevalenza di parti ospedalieri, aumento dei parti cesarei, frequente utilizzo di antibiotici, più elevati standard igienici etc.) e tende a condizionare lo status immunologico dell’individuo per tutta la sua esistenza.
Tra il microbiota intestinale e l’ospite esiste un delicato equilibrio, che viene mantenuto tramite vari meccanismi, tra cui ricordiamo:
- secrezione di acido gastrico, muco, sali biliari e Ig mucosali;
- pH mucoso
- motilità intestinale
- immunità locale e sistemica
- interazioni tra differenti specie microbiche.
Ovviamente, tutte le condizioni in cui uno o più di questi meccanismi risultano alterati possono determinare uno squilibrio nella relazione microbiota-ospite e potenzialmente provocare la comparsa di malattie gastrointestinali o extra-intestinali. Le malattie che possono derivare dall’alterazione quali-quantitativa del microbiota intestinale sono numerose, e vengono nel loro insieme definite “Gut Microbiota Related Diseases”.
Un altro elemento essenziale per la funzione della barriera intestinale è costituito dell’epitelio intestinale e in particolare dalle tight junctions delle cellule epiteliali apicali, che hanno il compito di opporsi “fisicamente” alla penetrazione di batteri e di sostanze potenzialmente dannose per l’organismo; di recente è stato osservato che le tight junctions sono regolate, nel loro funzionamento, dalle citochine prodotte a livello intestinale e possono essere alterate da svariati fattori, tra cui il consumo di alcool, gli squilibri alimentari e l’azione di tossine batteriche.
Diversi studi sono stati di recente dedicati anche al layer mucoso, che viene prodotto dalla secrezione di muco da parte delle goblet cells gastrointestinali e ha una importante funzione protettiva in quanto riveste internamente la parete intestinale e coadiuva al mantenimento della funzione di barriera intestinale. Lo spessore di questo strato mucoso viene mantenuto sempre relativamente costante, grazie all’equilibrio esistente tra sintesi, secrezione e degradazione del muco (che vengono a loro volta modulate dagli enzimi glicosidasi e proteasi del microbiota intestinale) e dalle forze meccaniche della peristalsi. Anche per quanto riguarda il layer mucoso, esistono svariati fattori che ne possono determinare l’alterazione, traducendosi in aumentata permeabilità di parete e in possibile comparsa di condizioni patologiche anche gravi. È noto che nell’ambito del layer mucoso esiste una “zona esterna” (outer layer), naturale habitat della flora intestinale, e una “zona interna”(inner layer), che ha funzione protettiva vera e propria. Le condizioni patologiche che favoriscono la penetrazione dei batteri dalla zona esterna a quella interna tendono a danneggiare la funzione di barriera di quest’ultima, specialmente quando si tratta di batteri patogeni e non di semplici commensali. Nell’ambito della barriera intestinale, una funzione importante viene rivestita anche dal sistema immunologico locale, che viene distinto in “innato” e “acquisito”; esiste una stretta relazione tra cibi ingeriti, flora microbica e cellule dell’immunità locale, la cui integrità è essenziale per prevenire l’insorgenza di varie patologie, in particolare quelle autoimmuni.
Non va sottovalutato inoltre il ruolo della rete (“pathway”) vascolare e linfatica nella regolazione della barriera intestinale; recenti studi hanno dimostrato infatti che, in condizioni di notevole sforzo fisico (come ad esempio nel corso di attività sportive agonistiche), in persone altrimenti sane, si può avere una alterazione della permeabilità intestinale, dovuta alla vasocostrizione splancnica associata a vasodilatazione dei distretti vascolari periferici.
Il sistema endocrino e neuroenterico intestinale è composto da almeno 14 diversi tipi di cellule derivanti dalla cresta neurale, che producono almeno 33 differenti tipi di ormoni e amine biogeniche; i componenti di tale sistema hanno molte caratteristiche in comune con le cellule del Sistema Nervoso Centrale e hanno meccanismi d’azione di vario tipo (endocrino, paracrino e autocrino). Anche il mantenimento di una corretta funzionalità di questo sistema è importante per l’integrità della barriera intestinale. È stato infatti osservato che, in condizioni di stress emotivo (ad es. nei pazienti con sindrome dell’intestino irritabile), la permeabilità della barriera intestinale aumenta, e ciò sarebbe almeno in parte dovuto ad una iperstimolazione del sistema endocrino e neuroenterico locale. Non va infine dimenticato il ruolo degli enzimi digestivi nella regolazione della permeabilità intestinale e il fatto che una loro disfunzione, come ad esempio nella celiachia grave, può favorire un massivo passaggio di macroantigeni e batteri attraverso la parete intestinale, con effetti deleteri sulla salute. Da quanto si è esposto, appare evidente che la funzione di barriera intestinale viene regolata da un fine e complesso equilibrio tra fattori legati sia all’ospite che alla composizione del microbiota intestinale. Qualsiasi alterazione significativa di tale equilibrio avrà come conseguenza un aumento della permeabilità intestinale e la possibile insorgenza di malattie.
È attualmente possibile, tramite sofisticati sistemi di indagine di laboratorio, valutare quantitativamente la permeabilità intestinale; è stato in tal modo possibile distinguere i fattori che influiscono sul corretto funzionamento della barriera intestinale in due grandi categorie:
- fattori fisiologici (cibo, stress, esercizio fisico);
- fattori patologici (malattie gastrointestinali ed extraintestinali).
Tra i fattori fisiologici, il più importante è ovviamente rappresentato dall’alimentazione; è stato ad esempio dimostrato che alcune sostanze possono migliorare la funzione della barriera intestinale, agendo sulle tight junctions e sulla produzione di muco, mentre altre possono invece peggiorarla.
Le condizioni patologiche che possono alterare la permeabilità intestinale sono numerose, e includono patologie gastrointestinali (celiachia, IBD, gastroenteriti etc), patologie internistiche (ad es. scompenso cardiaco, diabete mellito, malattie autoimmuni), le principali epatopatie (steatosi, steatoepatite e soprattutto cirrosi), ustioni, traumi e patologie psichiatriche.
Sono disponibili varie strategie terapeutiche per correggere una disfunzione della barriera intestinale, e la scelta va operata in rapporto al componente della barriera che risulta alterato:
- agire sul microbiota intestinale, ad es. regolando in maniera opportuna l’alimentazione (sia per quanto riguarda l’apporto calorico che la composizione della dieta), evitando l’utilizzo incongruo della terapia antibiotica e rimuovendo, laddove possibile, le condizioni predisponenti all’alterazione del microbiota (diabete, disturbi endocrini, disturbi della motilità intestinale etc);
- potenziare il sistema immunitario mucosale: ad es. è stato evidenziato che alcuni agenti biologici sono in grado di migliorare la funzione immunitaria locale e ridurre la permeabilità intestinale nei pazienti con IBD.
- migliorare la funzione di protezione muco-epiteliale, ad es. con l’utilizzo di probiotici o nuovi compound come la gelatina tannato, una sostanza che si è dimostrata in grado di formare un film protettivo mucoadesivo a livello intestinale e di ridurre l’infiammazione della parete derivante da fenomeni di fermentazione intestinale, nonché di migliorare la gestione clinica della diarrea acuta e subacuta nel bambino.
Un aspetto emergente, nonché una sfida per il futuro, è rappresentato dalla necessità di introdurre in terapia dei probiotici/prebiotici/postbiotici efficaci, in grado di stabilizzare il macrobiota intestinale e di ripristinare le specie commensali “a rischio”.
Va infine sottolineato quanto sia importante l’utilizzo, per il trattamento delle malattie infettive, di nuovi agenti antimicrobici, a spettro più ristretto e selettivo, in grado di minimizzare i potenziali danni a carico della flora intestinale, i quali invece possono spesso derivare dall’impiego indiscriminato di antibiotici a largo spettro.
Per la corrispondenza:
UOC
Medicina Interna e Gastroenterologia
Policlinico Universitario “A. Gemelli”
Università Cattolica del Sacro Cuore – Roma